Sejarah Helio, Properti, Struktur, Risiko, Penggunaan

- 963
- 104
- Ray Thiel
Dia helium Itu adalah elemen kimia yang simbolnya. Ini adalah gas mulia pertama dalam tabel periodik, dan biasanya terletak di ujung yang sama. Dalam kondisi normal itu adalah gas inert, karena tidak ada beberapa senyawa yang stabil; Itu juga mengembang dengan sangat cepat dan merupakan zat dengan titik didih sekecil apa pun dari semuanya.
Pada tingkat populer itu adalah gas yang terkenal, karena dalam peristiwa yang tak terhitung banyaknya atau pesta anak -anak itu biasa. Namun, apa yang benar -benar hilang ke sudut -sudut tata surya, dan seterusnya, mereka adalah atom helium yang dilepaskan begitu dunia rusak.
 Balon yang meningkat dengan helium, yang terdekat dengan elemen ini dalam situasi sehari -hari. Sumber: Pixabay.
Balon yang meningkat dengan helium, yang terdekat dengan elemen ini dalam situasi sehari -hari. Sumber: Pixabay. Faktanya, ada orang -orang yang, dan dengan alasan yang bagus, percaya bahwa balon helium mewakili praktik yang tidak pantas untuk gas ini. Untungnya, ini memiliki kegunaan yang lebih penting dan menarik, berkat sifat fisik dan kimianya yang memisahkannya dari elemen kimia lainnya.
Misalnya, helium cair sangat dingin sehingga dapat membekukan apa saja, sebagai paduan logam, menjadikannya bahan superkonduktor. Itu juga cairan yang memanifestasikan superfluiditas, mampu memanjat dinding wadah kaca.
Namanya karena dia pertama kali diidentifikasi di bawah sinar matahari dan bukan di bumi. Ini adalah elemen paling melimpah kedua di seluruh alam semesta dan, meskipun konsentrasinya konyol di kerak bumi, ia dapat diperoleh dari cadangan gas alam dan mineral radioaktif uranium dan thorium.
Di sini helium menunjukkan fakta aneh lainnya: itu adalah gas yang jauh lebih banyak di lapisan tanah daripada di atmosfer, di mana ia akhirnya melarikan diri dari bumi dan medan gravitasinya.
[TOC]
Sejarah
Helium tidak ditemukan di bumi tetapi di bawah sinar matahari. Faktanya, namanya berasal dari kata Yunani 'helios' yang berarti matahari. Keberadaan unsur saja kontras dengan tabel periodik Dmitri Mendeléyev, karena tidak ada tempat untuk gas baru; yaitu, saat itu sama sekali tidak ada tentang gas mulia.
Nama 'Helio', ditulis sebagai 'helium' dalam bahasa Inggris, diakhiri dengan akhiran -IM yang menyebutnya sebagai logam; Justru karena keberadaan gas lain selain oksigen, hidrogen, fluor, klorin dan nitrogen tidak dapat diakui.
Nama ini ditunjuk oleh astronom Inggris Norman Lockyer, yang belajar dari Inggris apa yang diamati oleh Astronom Prancis.
Itu adalah garis spektral kuning dari elemen yang tidak diketahui sampai saat itu. Lockyer mengatakan bahwa ini karena adanya elemen kimia baru yang ditemukan di bawah sinar matahari.
Pada tahun 1895, hampir dua puluh tahun kemudian, ahli kimia Skotlandia Sir William Ramsay mengenali spektrum yang sama dari gas yang tersisa saat mempelajari mineral radioaktif: Cleveíta. Karena itu ada helio di sini juga.
Sifat fisik dan kimia
Penampilan
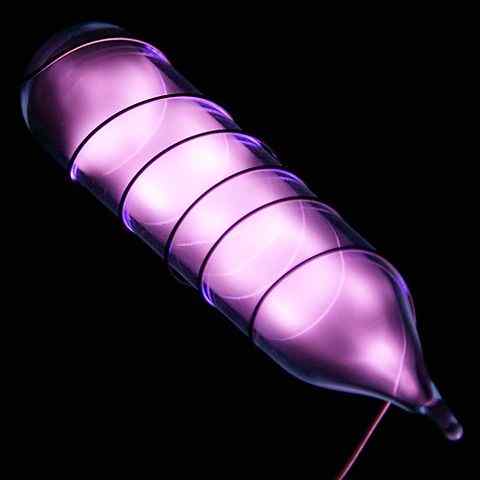 Ampul dengan sampel helium bersinar setelah sengatan listrik. Sumber: Gambar Hi-Res dari Elemen Kimia [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]
Ampul dengan sampel helium bersinar setelah sengatan listrik. Sumber: Gambar Hi-Res dari Elemen Kimia [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] Helium adalah gas yang tidak berwarna dan tidak berbau, yang tidak memiliki rasa dan juga lembam. Namun, ketika sengatan listrik diterapkan, dan tergantung pada perbedaan tegangan, itu mulai bersinar seperti kabut moral keabu-abuan (gambar atas), untuk kemudian bersinar dengan cahaya oranye. Oleh karena itu, lampu helium berwarna oranye.
Nomor Atom (Z)
2
Masa molar
4.002 g/mol
Titik lebur
-272.2 ºC
Titik didih
-268.92 ºC
Kepadatan
-0,1786 g/L, dalam kondisi normal, yaitu dalam fase gas.
-0,145 g/ml, pada titik leleh, helium cair.
-0,125 g/ml, tepat ketika helium mulai mendidih.
-0,187 g/ml, pada 0 K dan 25 atm, yaitu, helium padat untuk tekanan dan kondisi suhu spesifik tersebut.
Tiga poin
2.177 K dan 5.043 kPa (0,04935 ATM)
Titik kritis
5.1953 K dan 0,22746 MPa (2.2448 ATM)
Panas fusi
0,0138 kJ/mol
Panas penguapan
0,0829 kJ/mol
Kapasitas panas molar
20.78 J/(mol · k)
Tekanan uap
0,9869 ATM pada 4,21 K. Nilai ini berfungsi untuk memberikan gambaran tentang bagaimana armada.
Energi ionisasi
-Pertama: 2372.3 kJ/mol (dia+ gas)
-Kedua: 5250.5 kJ/mol (dia2+ gas)
Energi ionisasi untuk helium sangat tinggi karena atom gas harus kehilangan elektron, yang mengalami beban nuklir yang efektif yang kuat. Ini juga dapat dipahami jika ukuran kecil atom dipertimbangkan dan bagaimana "dekat" adalah dua elektron sehubungan dengan nukleus (dengan dua proton dan dua neutron).
Kelarutan
Di dalam air, 0,97 mL dilarutkan per 100 ml air pada 0 ºC, yang berarti sedikit larut.
Dapat melayani Anda: amonium oksalatReaktivitas
Helium adalah unsur kimia paling tidak reaktif kedua di alam. Dalam kondisi normal, berhasil menegaskan bahwa itu adalah gas inert; Tidak pernah (untuk apa yang tampaknya) dapat dimanipulasi senyawa helium di ruangan atau laboratorium tanpa tekanan besar yang bekerja di atasnya; Atau mungkin, suhu tinggi atau rendah dramatis.
Contoh yang kita lihat di senyawa NA2Dia, yang hanya stabil di bawah tekanan 300 GPa, direproduksi dalam sel Yunque berlian.
Sedangkan ikatan kimia di NA2Memiliki "orang asing" karena memiliki elektron yang terletak dengan baik di kristal, mereka jauh dari interaksi sederhana dinding van der dan, oleh karena itu, tidak hanya terdiri dari atom helium yang terperangkap oleh agregat molekuler. Di sinilah dilema di mana senyawa helium itu nyata dan yang tidak.
Misalnya, molekul nitrogen untuk tekanan tinggi dapat memenjarakan atom helium untuk menyebabkan semacam dendam2)sebelas.
Juga, ada kompleks endo -subversi dari kation fullerene, c60+N dan C70+N, di dalam rongga mereka dapat menampung atom helium; dan kation molekuler heh+ (He-H+), ditemukan dalam nebula yang sangat jauh.
Nomor oksidasi
Yang keluar dari rasa ingin tahu mencoba menghitung nomor oksidasi untuk helium di salah satu senyawanya akan menemukan bahwa ini sama dengan 0. Di na2Dia, misalnya, dapat dianggap bahwa formulanya sesuai dengan ion hipotetis2+Dia2-; Tetapi seperti itu untuk berasumsi bahwa ia memiliki karakter ionik murni, padahal pada kenyataannya hubungannya jauh dari menjadi.
Selain itu, helium tidak memenangkan elektron karena tidak dapat mengakomodasi mereka dalam orbital 2S, energi yang tidak tersedia; Dan tidak mungkin Anda kehilangan mereka, karena berkurangnya ukuran atomnya dan beban nuklir nuklirnya yang sangat efektif. Itulah sebabnya helium selalu berpartisipasi (secara teori) sebagai atom0 Dalam senyawa yang diturunkan.
Struktur dan konfigurasi elektronik
Helium, seperti semua gas yang diamati dalam makroescala, menempati volume wadah yang menyimpannya, sehingga memiliki cara yang tidak terbatas. Namun, ketika suhu turun dan mulai mendingin di bawah -269 ºC, gas mengembun dalam cairan yang tidak berwarna; Helium I, yang pertama dari dua fase cair untuk elemen ini.
Alasan mengapa helium mengembun pada suhu rendah adalah karena beberapa kekuatan dispersi yang menyatukan atom mereka; Apapun fase yang dipertimbangkan. Ini dapat dijelaskan dari konfigurasi elektroniknya:
1s2
Di mana dua elektron menempati orbital atom 1S. Atom helium dapat divisualisasikan sebagai bidang yang hampir sempurna, yang pinggiran elektroniknya homogen tidak terlalu rentan untuk dipolarisasi oleh beban nuklir yang efektif dari dua proton dalam nukleus.
Dengan demikian, momen dipol spontan dan terinduksi tidak umum dan sangat lemah; Jadi suhu harus mendekati nol absolut sehingga atom -atom telah mendekati kelambatan yang cukup dan membuat kekuatan dispersifnya mendefinisikan cairan; Atau bahkan lebih baik, kaca helium.
Dimer
Dalam fase gas ruang yang memisahkan atom memiliki sedemikian rupa sehingga dapat diasumsikan bahwa salah satu yang lain selalu dipisahkan. Sedemikian rupa sehingga dalam lepuh, volume kecil, helium terlihat tidak berwarna sampai mengalami sengatan listrik, yang mengionisasi atom -atomnya dalam kabut keabu -abuan dan kecil.
Namun, dalam fase cair atom memiliki, bahkan dengan interaksi yang lemah, mereka tidak dapat lagi "mengabaikan" untuk waktu yang lebih lama. Sekarang kekuatan dispersi memungkinkan mereka2. Oleh karena itu, Anda dapat menganggap helium I sebagai kelompok besar dia2 seimbang dengan atom fase uapnya.
Itulah sebabnya helium I sangat sulit untuk dibedakan dari uapnya. Jika cairan ini tumpah di luar wadah hermetisnya, ia melarikan diri seperti suar keputihan.
Helio II
Ketika suhu turun lebih banyak lagi, menyentuh 2.178 K (-270.972 ºC), transisi fase terjadi: helium I diubah menjadi helium II.
Dari titik ini, cairan helium yang menarik menjadi cairan berlebihan atau kuantum; yaitu, sifat makroskopisnya dimanifestasikan seolah -olah dimer2 Mereka adalah atom individu (dan mungkin mereka). Itu tidak memiliki viskositas lengkap, karena tidak ada permukaan yang dapat menghentikan atom selama geser atau "memanjat".
Itulah sebabnya Helio II dapat naik melalui dinding wadah kaca yang mengatasi gaya gravitasi; Terlepas dari seberapa tinggi mereka, selama permukaan tetap pada suhu yang sama dan, oleh karena itu, jangan menguap.
Itu dapat melayani Anda: asam hipofisis (h3po2): sifat, penggunaan dan reagenKarena itu, helium cair tidak dapat disimpan dalam wadah kaca, karena itu akan keluar sebelum celah atau celah sekecil apa pun; Sangat mirip dengan bagaimana itu bisa terjadi dengan gas. Sebaliknya, stainless steel digunakan untuk merancang wadah ini (tangki Dewars).
Kristal
Meskipun suhu turun hingga 0 K (nol absolut), gaya dispersi antara atom saya tidak akan cukup kuat untuk memesannya dalam struktur kristal. Untuk membuat pemadatan, tekanan harus meningkat menjadi sekitar 25 atm; Dan kemudian, kristal heksagonal kompak muncul (hcp).
Studi geofisika menunjukkan bahwa struktur HCP ini masih belum berubah sejauh tekanan meningkat (hingga urutan Pascal Giga, GPa). Namun, ada daerah sempit dalam diagram suhu tekanan di mana kristal HCP ini menderita transisi ke fase kubik yang berpusat pada tubuh (BCC).
Dimana itu dan dapatkan
Kosmos dan batu
 Helium mewakili elemen paling banyak kedua dari alam semesta dan 24% dari massanya. Sumber: Pxhere.
Helium mewakili elemen paling banyak kedua dari alam semesta dan 24% dari massanya. Sumber: Pxhere. Helium adalah elemen paling berlimpah kedua di seluruh alam semesta, hanya dilampaui oleh hidrogen. Bintang -bintang terus -menerus menghasilkan jumlah atom helium yang tak terukur dengan menggabungkan dua inti hidrogen selama proses nukleosintesis.
Demikian juga, setiap proses radioaktif yang memancarkan partikel α adalah sumber produksi atom helium jika mereka berinteraksi dengan elektron lingkungan; Misalnya, dengan bodi batu di tangki mineral radioaktif uranium dan thorium. Kedua elemen ini menderita peluruhan radioaktif, dimulai dengan uranium:
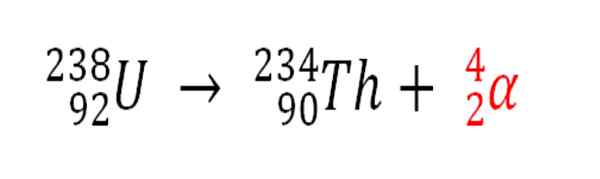 Peluruhan radioaktif dalam uranium dalam pembentukan partikel ALFAS, yang kemudian berubah menjadi atom helium dalam endapan bawah tanah. Sumber: Gabriel Bolívar.
Peluruhan radioaktif dalam uranium dalam pembentukan partikel ALFAS, yang kemudian berubah menjadi atom helium dalam endapan bawah tanah. Sumber: Gabriel Bolívar. Oleh karena itu, di bebatuan di mana mineral radioaktif ini terkonsentrasi, atom helium akan terperangkap, yang akan dilepaskan setelah dicerna dalam media asam.
Di antara beberapa mineral ini adalah Cleveíta, Carnotita, dan Uraninite, semuanya terdiri dari uranium oksida (UO2 atau u3SALAH SATU8) dan kotoran thorium, logam berat dan tanah jarang. Helium, irigasi melalui saluran bawah tanah, dapat berakhir di reservoir gas alam, mata air mineral atau di setrika meteorik.
Diperkirakan bahwa massa helium yang setara dengan 3000 ton diproduksi setiap tahun, dari peluruhan radioaktif uranium dan thorium.
Udara dan laut
Helium tidak terlalu larut di dalam air, sehingga lebih cepat daripada nanti akhirnya naik dari kedalaman (di mana asalnya ditemukan), untuk melintasi lapisan atmosfer dan akhirnya mencapai ruang sidereal. Atom -atomnya sangat kecil dan ringan sehingga medan gravitasi bumi tidak dapat mempertahankannya di atmosfer.
Karena di atas, konsentrasi helium baik di udara (5,2 ppm) dan di laut (4 ppt) sangat rendah.
Jika Anda ingin mengekstrak dari salah satu dari kedua media itu, opsi "terbaik" adalah udara, yang pertama -tama harus mengirimkannya ke pencairan untuk memadatkan semua gas komponennya, sementara helium tetap dalam keadaan gas gasousous.
Namun, tidak praktis untuk mendapatkan helium dari udara, tetapi dari bebatuan yang diperkaya dengan mineral radioaktif; atau lebih baik lagi, cadangan gas alam, di mana helium dapat mewakili hingga 7% dari total massa.
Pencairan dan distilasi gas alam
Alih -alih menundukkan udara, itu lebih mudah dan lebih menguntungkan. Dengan demikian, bahan baku par excellence (komersial) untuk mendapatkan helium adalah gas alam, yang juga dapat diserahkan ke distilasi fraksional.
Produk akhir distilasi selesai dimurnikan dengan karbon aktif, yang melewati helium kemurnian yang hebat. Dan akhirnya, helium terpisah dari neon melalui proses cryogenic di mana helium cair digunakan.
Isotop
Helium disajikan di alam terutama sebagai isotop 4Dia, yang nukleus telanjangnya adalah partikel terkenal α. Atom ini 4Saya memiliki dua neutron dan dua proton. Berlimpahnya lebih rendah adalah isotop 3Dia, yang hanya memiliki satu neutron. Yang pertama lebih berat (memiliki massa atom yang lebih besar) dari yang kedua.
Dengan demikian, pasangan isotop 3Dia dan 4Memiliki yang mendefinisikan sifat yang dapat disentuh dan apa yang kita pahami tentang helium sebagai elemen kimia. Sejak 3Dia lebih ringan, diasumsikan bahwa atom -atom mereka memiliki lebih banyak energi kinetik dan, oleh karena itu, mereka membutuhkan suhu yang lebih rendah untuk kohesif dalam hal yang berlebihan.
Dia 3Saya telah mempertimbangkan spesies yang sangat langka di bumi; Namun, di tanah bulan itu lebih berlimpah (sekitar 2000 kali). Itulah sebabnya Bulan tunduk pada proyek dan cerita sebagai sumber yang memungkinkan 3Dia, yang dapat digunakan sebagai bahan bakar nuklir untuk pesawat ruang angkasa di masa depan.
Dapat melayani Anda: zat murniDi antara isotop helium lainnya dapat disebutkan, dengan waktu setengah kehidupan masing -masing: 5DIA (T1/2= 7.6 · 10−22 S), 6DIA (T1/2= 0,8 dtk) dan 8DIA (T1/2= 0,119 s).
Risiko
Helium adalah gas inert dan, oleh karena itu, tidak berpartisipasi dalam reaksi apa pun yang terjadi di dalam tubuh kita.
Atom -atomnya secara praktis masuk dan dihembuskan tanpa interaksinya dengan biomolekul yang menghasilkan efek selanjutnya; Kecuali dalam suara yang dipancarkan dari pita suara, yang menjadi lebih akut dan memiliki lebih banyak frekuensi.
Orang yang menghirup helio balon (secukupnya), berbicara dengan suara akut, mirip dengan tupai (atau bebek).
Masalahnya terletak pada fakta bahwa jika orang tersebut menghirup jumlah helium yang tidak tepat, risiko mencekik, karena atom mereka beralih ke molekul oksigen; Dan oleh karena itu, ia tidak akan dapat bernafas sampai semua helium menghembuskan napas, yang pada gilirannya karena tekanannya dapat merobek jaringan paru atau menyebabkan barotrauma.
Kasus orang yang telah meninggal karena helio yang menghirup telah dilaporkan karena yang baru dijelaskan.
Di sisi lain, meskipun tidak mewakili risiko kebakaran karena kurangnya reaktivitas terhadap oksigen (atau zat lain), jika disimpan di bawah tekanan tinggi dan melarikan diri, pelariannya dapat secara fisik berbahaya secara fisik.
Aplikasi
Sifat fisik dan kimia Helio tidak hanya menjadikannya gas khusus, tetapi juga zat yang sangat berguna untuk aplikasi yang pantas suhu dalam hal yang sangat rendah. Di bagian ini beberapa aplikasi atau penggunaan ini akan ditangani.
Sistem tekanan dan pembersihan
Dalam beberapa sistem, perlu untuk meningkatkan tekanan (tekanan), dan untuk ini harus disuntikkan atau pasokan yang tidak berinteraksi dengan komponennya; Misalnya, dengan reagen atau permukaan yang peka terhadap reaksi yang tidak diinginkan.
Dengan demikian, tekanan dapat ditingkatkan dengan volume helium, yang inersia kimianya membuatnya ideal untuk tujuan ini. Atmosfer lembam yang memfasilitasi melebihi kasus nitrogen tertentu.
Untuk proses sebaliknya, yaitu, pembersihan, helium juga digunakan karena kemampuannya untuk menyeret semua oksigen, uap air atau gas lainnya, yang kehadirannya ingin menghilangkan. Dengan cara ini tekanan sistem berkurang begitu helium dikosongkan.
Deteksi kebocoran
Helium dapat disaring melalui celah sekecil apa pun, sehingga juga berfungsi untuk mendeteksi kebocoran pada pipa, wadah vacuum tinggi atau tangki kriogenik.
Terkadang deteksi dapat dilakukan secara visual atau dengan sentuhan; Namun, sebagian besar detektor adalah apa yang "melempar" sinyal di mana dan berapa banyak helium yang keluar dari sistem yang sedang diperiksa.
Seret gas
Atom helium, sebagaimana disebutkan untuk sistem pembersihan, dapat menyeretnya, tergantung pada tekanan Anda, molekul yang lebih berat. Misalnya, prinsip ini digunakan setiap hari dalam analisis kromatografi gas, karena dapat menyeret sampel yang diatomisasi di sepanjang kolom, di mana ia berinteraksi dengan fase stasioner.
Balon dan pesawat
 Helium digunakan untuk mengembang pesawat dan jauh lebih aman daripada hidrogen karena bukan gas yang mudah terbakar. Sumber: Pixabay.
Helium digunakan untuk mengembang pesawat dan jauh lebih aman daripada hidrogen karena bukan gas yang mudah terbakar. Sumber: Pixabay. Karena kepadatannya yang rendah dibandingkan dengan udara dan, sekali lagi, kurangnya reaktivitas dengan oksigen, telah digunakan untuk mengembang balon di pesta anak -anak (dicampur dengan oksigen sehingga tidak ada yang mati lemas untuk bernafas), dan udara (gambar superior) , tanpa bisa mewakili risiko kebakaran.
Menyelam
 Helium adalah salah satu komponen utama tangki oksigen yang dengannya penyelam bernafas. Sumber: Pxhere.
Helium adalah salah satu komponen utama tangki oksigen yang dengannya penyelam bernafas. Sumber: Pxhere. Ketika penyelam turun ke kedalaman yang lebih besar, mereka merasa sulit untuk bernafas sebagai akibat dari tekanan besar yang diberikan oleh air. Itulah sebabnya Helio ditambahkan dalam tangki oksigennya untuk mengurangi kepadatan gas yang dihembuskan oleh penyelam dan napas, dan dengan demikian, dapat dihembuskan dengan lebih sedikit pekerjaan.
Las busur
Dalam proses pengelasan, busur listrik membawa panas yang cukup sehingga kedua logam bergabung. Jika dilakukan di bawah atmosfer helium, logam pijar tidak akan bereaksi dengan oksigen udara untuk menjadi oksida masing -masing; Oleh karena itu, helium mencegah hal ini terjadi.
Superkonduktor
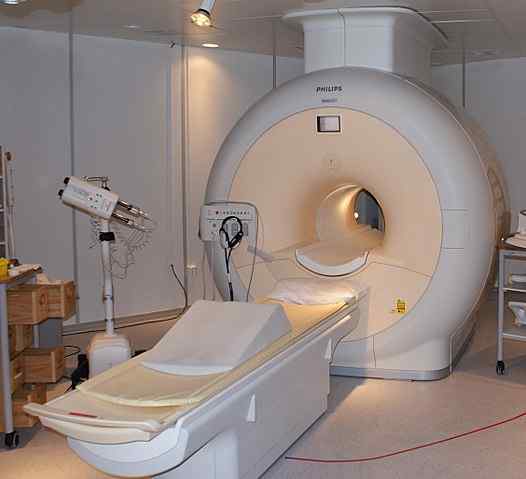 Helium cair digunakan untuk mendinginkan magnet yang digunakan dalam pemindai pencitraan resonansi magnetik nuklir. Sumber: Jan Ainali [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]
Helium cair digunakan untuk mendinginkan magnet yang digunakan dalam pemindai pencitraan resonansi magnetik nuklir. Sumber: Jan Ainali [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] Helium cair sangat dingin sehingga dapat membekukan logam untuk mengubahnya menjadi superkonduktor. Berkat ini, magnet yang sangat kuat telah diproduksi, yang, didinginkan dengan helium cair, telah digunakan dalam gambar gambar atau spektrometer resonansi magnetik nuklir.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Andy Estance. (17 April 2019). Ion helium hidrida terdeteksi di luar angkasa untuk pertama kalinya: bukti yang ditemukan untuk kimia yang sulit dipahami dari menit pertama alam semesta. Dipulihkan dari: ChemistryWorld.com
- Peter Wothers. (19 Agustus 2009). Helium. Kimia dalam elemennya. Dipulihkan dari: ChemistryWorld.com
- Wikipedia. (2019). Helium. Diperoleh dari: di.Wikipedia.org
- Mao, h. K., Wu, dan., Jephcoat, a. P., Hemley, r. J., Bell, hlm. M., & Bassett, W. KE. (1988). Struktur kristal dan kepadatan helium hingga 232 kbar. Diperoleh dari: Artikel.Adsab.Harvard.Edu
- Pusat Nasional Informasi Bioteknologi. (2019). Helium. Database pubchem. CID = 23987. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Mary-Ann Muffoletto. (6 Februari 2017). Up, Up and Away: Kimiawan mengatakan 'ya,' helium dapat membentuk senyawa. Universitas Negeri Utah. Pulih dari: Phys.org
- Steve Gagnon. (S.F.). Isotop elemen helium. Jefferson Lab. Pulih dari: pendidikan.Jlab.org
- Advameg, Inc. (2019). Helium. Pulih dari: chemistry explaed.com
- « Botol Bagian Leyden, Operasi, Eksperimen
- Lebih banyak latar belakang agraves, konten, konsekuensi »

