Struktur hidrazin, sifat, sintesis, penggunaan

- 4707
- 1038
- Ernesto Mueller
Itu Hidrazin Itu adalah senyawa anorganik yang formula kimianya adalah n2H4. Itu terdiri dari anggota keluarga hidror nitrogen, yang paling sederhana adalah yang paling sederhana dari semuanya. Meskipun molekulnya tampak kesederhanaan, ia menunjukkan beberapa sifat kimia dan fisik yang menjadikan hidrazin zat yang menarik dan menjanjikan secara energik.
Jaga kesamaan yang dekat dengan air, karena keduanya ada sebagai zat cair dalam interval suhu yang sama. Dari hidrazin kita dapat memperoleh turunan organik dengan mengganti hidrogennya dengan kelompok berkarbonasi. Juga, dari itu disintesis hidrazon, hidrazida, dan garam hidrazin.
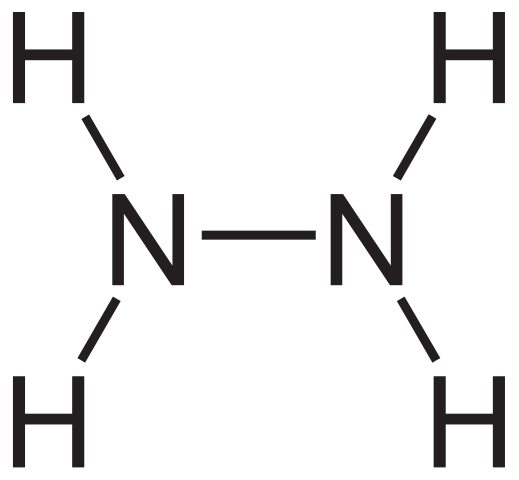 Formula Struktural Hidrazin. Sumber: Neurotoger via Wikipedia.
Formula Struktural Hidrazin. Sumber: Neurotoger via Wikipedia. Formula struktural hidrazin dapat dilihat di atas, yang dapat ditulis sebagai h2NNH2 atau h2N-NH2. Jika Anda melihat dengan cermat, tampaknya dua molekul NH3 Mereka akan saling terhubung. Namun, dalam pembentukan tautan N-N tidak hanya molekul amonia karena reagen terlibat.
Hidrazin adalah senyawa yang memiliki banyak aplikasi, karena merupakan prekursor yang sangat baik untuk simfin senyawa, baik organik maupun anorganik. Demikian juga, berkat kekuatan pengurangan dan produk dekomposisi, ditakdirkan untuk menghilangkan oksigen dan gas lainnya, mendapatkan logam mulia; Dan khususnya, untuk meningkatkan pesawat ruang angkasa dan state -do -the -art pesawat.
[TOC]
Struktur hidrasin
Molekul dan tautan
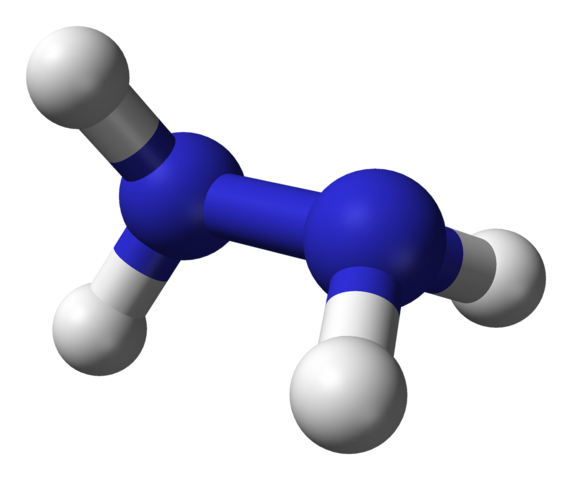 Struktur molekul hidrazin. Sumber: Ben Mills via Wikipedia.
Struktur molekul hidrazin. Sumber: Ben Mills via Wikipedia. Di gambar atas kita memiliki molekul hidrazin yang diwakili oleh model bola dan batang. Perhatikan bahwa orientasi spasial atom hidrogen, bola putih, kontras dengan kesan yang ditawarkan oleh formula struktural; yaitu, hidrogen keduanya2 Mereka tidak selaras atau dikalahkan, tetapi memiliki sudut rotasi 95º satu sama lain.
Faktanya, sangat banyak sehingga tautan N-N hampir tidak mampu berputar, memiliki penghalang energi yang harus berakhir untuk melampaui empat atom hidrogen.
Tentang apakah ini? Pada prinsipnya, untuk tolakan elektronik yang kuat yang saling mengalami dua pasang elektron soliter pada atom nitrogen. Sudut 95º ini adalah yang memberikan molekul hidrazin stabilitas terbesar.
Dapat melayani Anda: lithium bromide: struktur, sifat, penggunaan, risikoGeometri
Setiap atom nitrogen memiliki hibridisasi SP3, Mengadopsi geometri piramida segitiga. Oleh karena itu, dengan pasangan elektron bebas, molekul hidrasin seperti dua piramida yang dihubungkan oleh salah satu simpulnya dapat divisualisasikan, dan di mana pusat -pusat atom nitrogen akan ditemukan.
Interaksi antarmolekul
Formula H2NNH2 Saya bisa memberikan ide yang salah bahwa hidrazin adalah senyawa apolar untuk memiliki dua kelompok yang sama terkait. Namun, struktur molekul dan ikatan N-N yang diputar menunjukkan bahwa molekul tidak sepenuhnya simetris, juga menyebutkan bahwa pasangan elektron bebasnya tidak menunjuk ke arah yang bertentangan.
Ini berarti hidrazin, yang secara struktural dan elektronik asimetris, menghadirkan momen dipol. Dan karena itu, molekul mereka berinteraksi satu sama lain melalui dipol-dipol2NNH2-NH2NH2, yang bertanggung jawab untuk hidrazin memiliki titik didih yang sangat tinggi.
Sifat hidrasin
 Hidrazin hidrat. Sumber: lhchem/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0)
Hidrazin hidrat. Sumber: lhchem/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0) Penampilan fisik
Hidrazin adalah cairan tidak berwarna yang mirip dengan air sehubungan dengan viskositas dan kepadatan. Saat terbakar memancarkan uap putih, selain mendapatkan amonia dan ikan.
Masa molar
32.0452 g/mol
Titik lebur
2 ºC.
Titik didih
114 ºC. Perhatikan bahwa hidrazin ada dalam keadaan cair dalam interval suhu 2-114 ºC, sangat mirip dengan air, 0-100 ºC.
Kepadatan
1.021 g/cm3
Kepadatan uap
1.1 dalam hubungan udara.
Tekanan uap
Sekitar 0.010 ATM pada 30.7 ºC
Kelarutan
Hydrazine larut dengan air, serta dengan beberapa alkohol primer. Hidrazin membentuk hidrat dengan air, n2H4· H2Atau, yang ditandai dengan menjadi lebih padat dari hidrazin murni atau anhidrat. Hidrat ini adalah produk yang paling banyak dipasarkan, karena lebih stabil dan murah.
Momen dipolar
1.85 d. Ini adalah zat yang agak polar, hampir sama dengan air.
Itu dapat melayani Anda: asam yodium (HIO3): struktur, sifat, risiko dan penggunaanZat yang lengket dan kental
0.876 cp
Titik nyala
52 ºC
Suhu self -rection
Bervariasi tergantung pada zat atau permukaan yang bersentuhan. Misalnya, pada besi oksida terbakar pada suhu 23 ° C, saat pada kaca atau wadah lainnya tidak mulai meradang sampai 270 ºC.
Penguraian
Saat terbakar di udara itu terurai dalam nitrogen oksida, tidakX. Tetapi sehubungan dengan dekomposisi katalitiknya, yaitu, yang dipercepat oleh oksida logam atau logam, produk seperti amonia, nitrogen dan hidrogen diperoleh, dan sejumlah besar panas, yang akhirnya membentuk api yang terbakar tetapi tidak terlihat tetapi tidak terlihat.
Reaktivitas
Hidrazin adalah zat pereduksi yang baik, karena ketika teroksidasi menghasilkan air dan nitrogen, kedua senyawa yang tidak menderita reaksi sekunder.
Di sisi lain, hidrazin adalah nukleofil, karena menggunakan pasangan elektron bebas untuk bergabung dengan molekul organik lainnya. Demikian juga, itu bisa menderita ganti3, Untuk menghasilkan turunan teretilasi: ch3Nhnh2 atau (ch3)2NNH2.
Bereaksi dengan asam kuat untuk membentuk garam hidrazinio, n2H5X, dan dari hidrazonio, n2H6X2. Yang terakhir adalah yang paling umum. Hydrazinium sulfat, [n2H5] Hso4, Disiapkan dengan bereaksi hidrat hidrat dengan asam sulfat.
Basa
Hidrazin adalah basis yang lebih lemah dari amonia:
N2H4(Ac) + h2Atau (l) ⇌ n2H5+(Ac) + oh-(AC)
KB = 1.3 · 10-6
Ini karena asam konjugat hidrazinio2H5+ atau h3N+-NH2, memiliki beban yang tidak stabil oleh efek penarik dari kelompok NH2; yaitu, alih -alih memberikan kepadatan elektronik untuk nitrogen positif, penarikan.
Hidrazin mampu menderita protonasi kedua, jauh lebih kecil kemungkinannya, yang menghasilkan asam terkonjugasi yang bahkan lebih tidak stabil:
N2H5+(Ac) + h2Atau (l) ⇌ n2H6+(Ac) + oh-(AC)
KB = 8.4 · 10-16
Hydrazonium, n2H6+ atau h3N+-N+H3, Sangat tidak stabil karena tolakan antara beban positif dari kedua atom nitrogen. Namun, di perusahaan anion tertentu itu bisa ada sebagai garam.
Toksisitas
Anhydra Hydrazine adalah zat karsinogenik yang sangat beracun, kaustik, dan mungkin karsinogenik, belum lagi bahwa itu sangat eksplosif, jadi itu hanya boleh dimanipulasi di bawah protokol keamanan yang ketat.
Dapat melayani Anda: faktor kompresibilitas: cara menghitung, contoh dan latihanPerpaduan
Metode yang paling banyak digunakan untuk mensintesis hidrazin adalah proses raschig. Ini terdiri dari dua reaksi berikut:
NH3(AC) + NAOCL (AC) → NH2Cl (AC) + NaOH (AC)
2nh3(AC) + NH2Cl (ac) → n2H4(AC) + NH4Cl (ac)
Pada akhirnya hidrat N terbentuk2H4· H2Atau, yang disuling di hadapan KOH atau NaOH sebagai padatan kering:
N2H4· H2O → n2H4
Dengan cara ini hidrazin anhydra diperoleh dan tautan N-N terbentuk.
Penggunaan hidrazin
 Hydrazine adalah salah satu zat yang paling dihargai dalam boom aerospace. Sumber: Pxhere.
Hydrazine adalah salah satu zat yang paling dihargai dalam boom aerospace. Sumber: Pxhere. - Hidrazin, dengan adanya katalis logam, secara eksotental dipecah untuk menghasilkan nitrogen dan hidrogen, sehingga menyediakan energi yang cukup untuk meningkatkan pesawat terbang, roket dan satelit.
- Kecenderungan untuk memecah dan menyebabkan gas digunakan secara tepat untuk mengembang bahan polimer, seperti karet atau polietilen, mengubahnya menjadi busa masing -masing.
- Demikian juga, dengan melepaskan gas, ini dapat menyeret orang lain yang dilarutkan dalam pipa dari pipa, sehingga sangat berguna untuk menghilangkan oksigen dari boiler, sehingga menghindari korosi mereka.
- Hydrazine adalah bahan prekursor untuk banyak senyawa organik dengan fungsi farmakologis, antibungikida, herbisida, insektisida, pupuk, dll. Ini karena beragam turunan nitrogen siklik disintesis.
- Akhirnya, menjadi zat pereduksi yang baik, hidrazin dan garam hidraziniumnya digunakan untuk mengurangi mineral logam mulia, karena bernilai tinggi dalam industri metalurgi.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Hidrazin. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2020). Hidrazin. Ringkasan Pubchem Comunund untuk CID 9321. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Para editor Eeritlopaedia Britannica. (2020). Hidrazin. Britannica Encyclopaedia. Dipulihkan dari: Britannica.com
- Iridium selanjutnya. (20 Juni 2017). Hydrazine - Beracun untuk manusia, tetapi satelit menyukainya. Pulih dari: iridium.com

