Riwayat hidrogen, struktur, sifat dan penggunaan

- 5050
- 315
- Mr. Darrell Streich
Dia hidrogen Itu adalah elemen kimia yang diwakili oleh simbol h. Atomnya adalah yang terkecil dari semuanya dan dengan mana tabel periodik dimulai, di mana pun dia diposisikan. Ini terdiri dari gas tidak berwarna yang terdiri dari molekul diatomik H2, dan bukan untuk atom h; Seperti halnya gas mulia yang dia, ne, ar, antara lain.
Dari semua elemen, itu mungkin yang paling lambang dan disorot, tidak hanya untuk sifat -sifatnya dalam kondisi terestrial atau drastis, tetapi juga untuk kelimpahannya yang luar biasa dan variasi senyawanya. Hidrogen adalah gas, meskipun lembam tanpa adanya api, mudah terbakar dan berbahaya; Saat air, h2Atau, itu adalah pelarut dan kehidupan universal.
 Silinder merah digunakan untuk menyimpan hidrogen. Sumber: Famartin [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Silinder merah digunakan untuk menyimpan hidrogen. Sumber: Famartin [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Dengan sendirinya, hidrogen tidak menunjukkan kekhasan visual yang layak dikagumi, hanya menjadi gas yang disimpan dalam silinder merah atau hub. Namun, mereka adalah sifat dan kemampuannya untuk menghubungkan ke semua elemen, yang kembali ke hidrogen khusus. Dan semua ini, meskipun hanya memiliki elektron dari Valencia.
Jika hidrogen tidak disimpan di silinder masing -masing, itu akan lepas dari ruang sementara sebagian besar bereaksi di pendakian. Dan bahkan jika ia memiliki konsentrasi yang sangat rendah di udara yang kita hirup, di luar bumi dan di seluruh alam semesta, itu adalah elemen yang paling melimpah, berada di dalam bintang dan dianggap unit konstruksinya.
Di Bumi, di sisi lain, itu mewakili sekitar 10% dari total massanya. Untuk memvisualisasikan apa artinya ini, harus dipertimbangkan bahwa permukaan planet ini praktis ditutupi dengan lautan dan hidrogen ditemukan dalam mineral, dalam minyak minyak dan dalam senyawa organik apa pun, selain menjadi bagian dari semua makhluk hidup.
Seperti karbon, semua biomolekul (karbohidrat, protein, enzim, DNA, dll.) Mereka memiliki atom hidrogen. Oleh karena itu, ada banyak sumber untuk mengekstrak atau memproduksinya; Namun, sedikit yang mewakili metode produksi yang sangat menguntungkan.
[TOC]
Sejarah
Identifikasi dan Nama
Meskipun pada tahun 1671 Robert Boyle menyaksikan untuk pertama kalinya sebuah gas yang terbentuk ketika file besi bereaksi dengan asam, adalah ilmuwan Inggris Henry Cavendish, pada 1766, yang mengidentifikasi dia sebagai zat baru; "Udara yang mudah terbakar".
Cavendish menemukan bahwa ketika dugaan udara yang mudah terbakar ini terbakar, air dihasilkan. Berdasarkan pekerjaan dan hasilnya, ahli kimia Prancis Antoine Lavoisier memberi gas ini nama hidrogen pada 1783. Secara etimologis maknanya berasal dari kata -kata Yunani 'hidro' dan 'gen': performator air.
Elektrolisis dan bahan bakar
Tak lama setelah itu, pada tahun 1800, ilmuwan Amerika William Nicholson dan Sir Anthony Carlisle menemukan bahwa air dapat membusuk menjadi hidrogen dan oksigen; telah menemukan elektrolisis air. Selanjutnya, E 1838, ahli kimia Swiss Christian Friedrich Schoenbein memperkenalkan gagasan mengambil keuntungan dari pembakaran hidrogen untuk menghasilkan listrik.
Popularitas hidrogen begitu banyak sehingga bahkan penulis Julio Verne menyebutnya sebagai bahan bakar masa depan dalam bukunya Pulau misterius (1874).
Isolasi
Pada tahun 1899, ahli kimia Skotlandia James Dewar adalah yang pertama mengisolasi hidrogen sebagai gas cair, menjadi dirinya sendiri yang bisa mendinginkannya cukup untuk mendapatkannya dalam fase padatnya.
Dua saluran
Dari titik ini, sejarah hidrogen menyajikan dua saluran. Di satu sisi, pengembangannya di dalam bidang bahan bakar dan baterai; Dan di sisi lain, pemahaman tentang struktur atomnya dan bagaimana ia mewakili elemen yang membuka pintu ke fisika kuantum.
Struktur dan konfigurasi elektronik
 Molekul hidrogen diatomik. Sumber: Benjah-BMM27 [Domain Publik]
Molekul hidrogen diatomik. Sumber: Benjah-BMM27 [Domain Publik] Atom hidrogen sangat kecil dan nyaris tidak memiliki elektron untuk membentuk ikatan kovalen. Ketika dua atom ini bersatu, mereka memunculkan molekul diatomik, h2; Ini adalah hidrogen molekul gas (gambar superior). Setiap bola putih sesuai dengan atom H individu, dan bidang global ke orbital molekul.
Dengan demikian, hidrogen benar -benar terdiri dari molekul H2 Sangat kecil yang berinteraksi melalui kekuatan dispersi London, karena mereka tidak memiliki momen dipol karena menjadi homonuklear. Oleh karena itu, mereka sangat "gelisah" dan menyebar dengan cepat di ruang angkasa karena tidak ada kekuatan antarmolekul yang kuat untuk memperlambatnya.
Konfigurasi hidrogen elektronik hanyalah 1s1. Orbital ini, 1s, adalah produk dari resolusi persamaan Schrödinger yang terkenal untuk atom hidrogenoid. Dalam h2 Dua orbital 1s tumpang tindih untuk membentuk dua orbital molekul: satu dari tautan dan antienlace lainnya, menurut teori orbital molekul (TOM).
Orbital ini mengizinkan atau menjelaskan keberadaan ion H2+ atau h2-; Namun, kimia hidrogen didefinisikan dalam kondisi normal oleh h2 atau ion h+ atau h-.
Angka oksidasi
Dari konfigurasi elektronik untuk hidrogen, 1s1, Sangat mudah untuk memprediksi kemungkinan bilangan oksidasi; Diingat, tentu saja, bahwa orbital energi yang lebih besar tidak tersedia untuk tautan kimia. Dengan demikian, dalam keadaan basal hidrogen memiliki jumlah oksidasi 0, h0.
Itu dapat melayani Anda: nikel hidroksida (ii): struktur, sifat, penggunaan, risikoJika Anda kehilangan satu -satunya elektron, orbital 1S kosong dan kation atau ion hidrogen terbentuk, h+, mobilitas hebat di hampir semua media cair; terutama air. Dalam hal ini nomor oksidasi adalah +1.
Dan ketika yang sebaliknya terjadi, yaitu, memenangkan elektron, orbital sekarang akan memiliki dua elektron dan akan menjadi 1s2. Maka nomor oksidasi adalah -1, dan sesuai dengan anion hidrida, h-. Perlu dicatat bahwa h- Dia isolektronik untuk gas helium mulia, dia; yaitu, kedua spesies memiliki jumlah elektron yang sama.
Singkatnya, bilangan oksidasi hidrogen adalah: +1, 0 dan -1 dan molekul H2 menghitung seolah -olah mereka memiliki dua atom hidrogen h0.
Fase
Fase favorit hidrogen, setidaknya dalam kondisi terestrial, adalah soda, karena alasan yang sebelumnya dinyatakan. Namun, ketika suhu menurun dalam urutan -200 ºC, atau jika tekanan meningkat ratusan ribu kali daripada atmosfer, hidrogen dapat mengembun atau mengkristal dalam fase cair atau padat, masing -masing.
Dalam kondisi ini molekul h2 Mereka dapat menyelaraskan dengan berbagai cara untuk mendefinisikan pola struktural. Kekuatan dispersi London sekarang menjadi sangat terarah dan, oleh karena itu, geometri atau simetri yang diadopsi oleh teman sebaya muncul2.
Misalnya, dua HSSE h2, Itu seperti menulis (h2)2 Tentukan kotak simetris atau asimetris. Sementara itu, tiga pasang h2, atau (h2)3 Mereka mendefinisikan segi enam, sangat mirip dengan karbon dalam kristal grafit. Faktanya, fase heksagonal ini adalah yang utama atau paling stabil untuk hidrogen padat.
Tapi bagaimana jika padatan itu tidak disusun dari molekul tetapi dari h? Kemudian kami akan menangani hidrogen logam. Atom -atom H ini, mengingat bola putih, dapat menentukan fase cair dan padatan logam.
Properti
Penampilan fisik
Hidrogen adalah gas yang tidak berwarna, tidak berbau dan hambar. Oleh karena itu, jika ada kebocoran mewakili risiko ledakan.
Titik didih
-253 ºC.
Titik lebur
-259 ºC.
Titik pengapian dan stabilitas
Praktis meledak pada suhu berapa pun jika ada percikan atau sumber panas yang dekat dengan gas, bahkan sinar matahari dapat menembakkan hidrogen. Namun, selama itu disimpan dengan baik, itu sedikit gas reaktif.
Kepadatan
0,082 g/l. 14 kali lebih ringan dari udara.
Kelarutan
1,62 mg/L pada 21 ºC dalam air. Itu, secara umum, tidak larut di sebagian besar cairan.
Tekanan uap
1.24 · 106 mmHg pada 25 ºC. Nilai ini memberikan gambaran tentang seberapa tertutup silinder hidrogen harus mencegah gas melarikan diri.
Suhu self -rection
560vºC.
Elektronegativitas
2.20 pada skala Pauling.
Panas pembakaran
-285,8 kJ/mol.
Panas penguapan
0,90 kJ/mol.
Panas fusi
0,117 kJ/mol.
Isotop
Atom hidrogen "normal" adalah pratio, 1H, yang merupakan sekitar 99,985% hidrogen. Dua isotop lainnya untuk elemen ini adalah deuterium, 2H, dan tritium, 3H. Ini berbeda dalam jumlah neutron; Deuterium memiliki neutron, sedangkan tritio memiliki dua.
Isomer duri
Ada dua jenis hidrogen molekuler, h2: Ortho dan untuk. Pada pertama dua putaran (proton) atom H berorientasi ke arah yang sama (mereka paralel); Sementara di yang kedua, kedua putaran berada dalam arah yang berlawanan (mereka antiparalel).
Hidrogen-for adalah yang paling stabil dari dua isomer; Tetapi dengan meningkatkan suhu, hubungan ortho: menjadi 3: 1, yang berarti bahwa isomer hidrogen-organ mendominasi di atas yang lain. Pada suhu yang sangat rendah (dekat dengan nol absolut, 20k), hidrogen murni-untuk.
Tata nama
Nomenklatur untuk merujuk pada hidrogen adalah salah satu yang paling sederhana; Meskipun tidak sama untuk senyawa anorganik atau organik mereka. H2 Ini dapat dipanggil dengan nama -nama berikut selain 'hidrogen':
-Hidrogen molekuler
-Dihydrogen
-Molekul hidrogen diatomik.
Untuk ion h+ Nama mereka adalah proton atau ion hidrogen; Dan jika dalam media berair, h3SALAH SATU+, Kation hidronium. Sementara ion h- Itu adalah anion hidrida.
Atom hidrogen
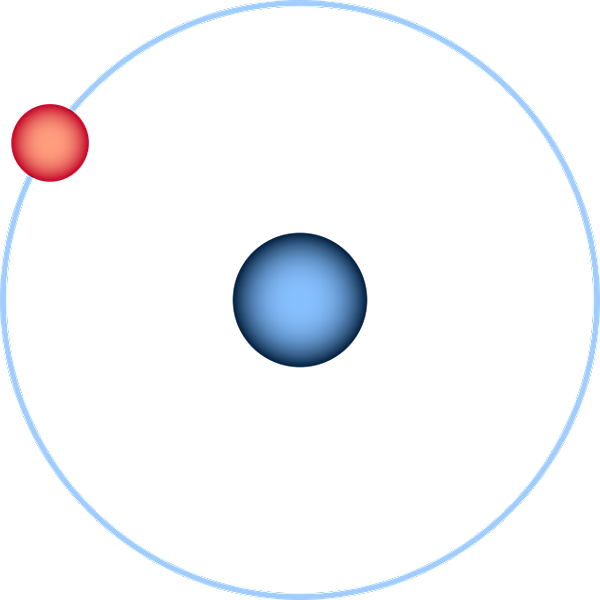 Atom hidrogen diwakili melalui model planet Bohr. Sumber: Pixabay.
Atom hidrogen diwakili melalui model planet Bohr. Sumber: Pixabay. Atom hidrogen adalah yang paling sederhana dan biasanya direpresentasikan seperti pada citra superior: inti dengan proton kesepian (untuk 1H), dikelilingi oleh elektron yang menarik orbit. Pada atom ini semua orbital atom untuk elemen lain dari tabel periodik telah dibangun dan diperkirakan.
Representasi yang lebih loyal terhadap pemahaman atom saat ini adalah bahwa dari sebuah bola yang pinggirannya ditentukan oleh awan elektronik dan probabilistik elektron (orbital 1S).
Dapat melayani Anda: termal: struktur, karakteristik, pembentukan, contohDimana dan produksi
 Bidang Bintang: Sumber Hidrogen yang Tidak Ada. Sumber: Pixabay.
Bidang Bintang: Sumber Hidrogen yang Tidak Ada. Sumber: Pixabay. Hidrogen adalah, meskipun mungkin pada tingkat yang lebih rendah dibandingkan dengan karbon, elemen kimia yang dapat dikatakan tanpa keraguan yang ada di mana -mana; Di udara, selain air yang mengisi laut, lautan dan tubuh kita, di dalam minyak mentah dan mineral, serta dalam senyawa organik yang dirakit untuk berasal dari kehidupan.
Cukup untuk melihat toko buku majemuk secara dangkal untuk menemukan atom hidrogen di dalamnya.
Pertanyaannya tidak terlalu banyak berapa banyak tetapi bagaimana itu hadir. Misalnya, molekul M2 Ini sangat fluktuatif dan reaktif di bawah kejadian sinar matahari, yang sangat langka di atmosfer; Oleh karena itu, bereaksi untuk bergabung dengan elemen lain dan dengan demikian mendapatkan stabilitas.
Sementara di atas, dalam kosmos, hidrogen terutama sebagai atom netral, h.
Faktanya, hidrogen dipertimbangkan, dalam fase logam dan kentalnya, seperti unit konstruksi bintang. Ketika ada jumlah yang tak terukur dari mereka dan, karena kekokohan dan dimensi kolosalnya, mereka menjadikan elemen ini yang paling melimpah dari seluruh alam semesta. Diperkirakan bahwa 75% dari materi yang diketahui sesuai dengan atom hidrogen.
Alami
Kumpulkan atom -atom hidrogen longgar di ruang terdengar tidak berubah dan mengekstraknya dari pinggiran matahari, atau samar -samar, tidak dapat dicapai. Di bumi, di mana kondisinya memaksa elemen ini ada sebagai h2, Itu dapat terjadi melalui proses alami atau geologis.
Misalnya, hidrogen memiliki siklus alami sendiri di mana bakteri tertentu, mikroba, dan ganggang dapat menghasilkannya melalui reaksi fotokimia. Eskalasi proses alami dan paralel dengan ini termasuk penggunaan bioreaktor, di mana bakteri memakan hidrokarbon untuk melepaskan hidrogen yang terkandung di dalamnya.
Makhluk hidup juga merupakan produsen hidrogen, tetapi pada tingkat yang lebih rendah. Jika demikian, itu tidak dapat dijelaskan bagaimana salah satu komponen gas perut merupakan komponen; yang telah menunjukkan secara berlebihan bahwa mereka mudah terbakar.
Akhirnya, perlu disebutkan bahwa dalam kondisi anaerob (tanpa oksigen), misalnya dalam lapisan bawah tanah, mineral dapat secara perlahan bereaksi dengan air untuk menghasilkan hidrogen. Reaksi Fayelita menunjukkannya:
3fe2Sio4 + 2 h2O → 2 Iman3SALAH SATU4 + 3 sio2 + 3 h2
Industri
Sementara biohidrogen adalah alternatif untuk menghasilkan gas ini pada skala industri, metode yang paling banyak digunakan adalah "untuk" mengambil "hidrogen ke senyawa yang mengandungnya, sehingga atom mereka bergabung bersama dan membentuk H2.
Metode lingkungan terkecil untuk memproduksinya terdiri dari bereaksi kokas (atau arang) dengan uap air yang terlalu panas:
C (S) + H2O (g) → co (g) + h2(G)
Demikian juga, gas alam telah digunakan untuk tujuan ini:
Ch4(g) + h2O (g) → co (g) + 3h2(G)
Dan karena jumlah kokas atau gas alam sangat luas, menguntungkan untuk menghasilkan hidrogen dengan salah satu dari dua reaksi ini.
Metode lain untuk mendapatkan hidrogen adalah menerapkan sengatan listrik ke air untuk menguraikannya di bagian dasarnya (elektrolisis):
2 h2Atau (l) → 2 jam2(g) + atau2(G)
Di laboratorium
Di laboratorium apa pun, hidrogen molekuler dapat disiapkan dalam jumlah kecil. Untuk melakukan ini, logam aktif harus bereaksi dengan asam yang kuat, baik dalam gelas atau dalam tabung reaksi. Gelembung yang dapat diamati adalah tanda yang jelas dari pembentukan hidrogen, diwakili oleh persamaan umum berikut:
M (S) + NH+(Ac) → mN+(Ac) + h2(G)
Dimana n adalah logam valencia. Jadi, misalnya, magnesium bereaksi dengan h+ Untuk menghasilkan h2:
Mg (s) + 2h+(Ac) → mg2+(Ac) + h2(G)
Reaksi
Rédox
Angka oksidasi sendiri menawarkan pendekatan pertama tentang bagaimana hidrogen berpartisipasi dalam reaksi kimia. H2 Saat bereaksi, itu bisa tetap tidak berubah, atau dibagi pada ion H+ atau h- tergantung pada spesies apa yang dihubungkannya; Jika mereka lebih atau kurang elektronegatif darinya.
H2 Ini sedikit reaktif karena kekuatan ikatan kovalennya, H-H; Namun, ini bukan hambatan mutlak untuk bereaksi dan membentuk senyawa dengan hampir semua elemen dari tabel periodik.
Reaksinya yang paling terkenal adalah dengan gas oksigen untuk menghasilkan uap air:
H2(g) + atau2(g) → 2h2O (g)
Dan itu adalah afinitas oksigen untuk membentuk molekul air yang stabil, yang bahkan dapat bereaksi dengan anion atau2- Dalam logam oksida tertentu:
H2(g) + cuo (s) → cu (s) + h2Atau (l)
Juga oksida perak bereaksi atau "mengurangi" dengan reaksi yang sama:
H2(g) + AUG (S) → Ag (S) + H2Atau (l)
Reaksi hidrogen ini sesuai dengan tipe Rédox. Yaitu, reduksi-oksidasi. Hidrogen mengoksidasi baik di hadapan oksigen dan oksida logam dari logam yang kurang reaktif daripada dia; Misalnya, tembaga, perak, tungsten, merkuri dan emas.
Penyerapan
Beberapa logam dapat menyerap hidrogen gas untuk membentuk hidror logam, yang dianggap seolah -olah mereka adalah paduan. Misalnya, logam transisi seperti paladium menyerap jumlah h yang terkenal2, mirip dengan spons logam.
Dapat melayani Anda: neodymium: struktur, sifat, penggunaanHal yang sama terjadi dengan paduan logam yang lebih kompleks. Dengan cara ini hidrogen dapat disimpan dengan cara lain selain silindernya.
Tambahan
Molekul organik juga dapat "menyerap" hidrogen melalui mekanisme molekuler dan/atau interaksi yang berbeda.
Untuk logam, molekul H2 Mereka dikelilingi oleh atom logam di dalam kristal mereka; Saat dalam molekul organik, ikatan H-H rusak untuk membentuk ikatan kovalen lainnya. Dalam arti yang lebih formal: hidrogen tidak diserap, tetapi ditambahkan ke struktur.
Contoh klasik adalah penambahan h2 Untuk menggandakan atau tiga tautan alkena atau alkine, masing -masing:
C = C + H2 → H-C-C-H
Cunjungi + H2 → hc = ch
Reaksi ini juga diberi nama hidrogenasi.
Formasi Hydros
Hidrogen bereaksi langsung terhadap unsur -unsur untuk membentuk keluarga senyawa kimia yang disebut hydros. Terutama ada dua jenis: Salinos dan molekul.
Ada juga hidror logam, yang terdiri dari paduan logam yang telah disebutkan ketika logam ini menyerap hidrogen gas; dan polimer, dengan jaringan atau rantai ikatan E-H, di mana ia menunjukkan elemen kimia.
Salinos
Dalam hidror salin, hidrogen berpartisipasi dalam ikatan ionik seperti anion hidrida, h-. Agar ini terbentuk, elemen harus kurang elektronegatif; Kalau tidak, itu tidak akan menyerahkan elektronnya untuk hidrogen.
Oleh karena itu, hydros saline hanya terbentuk ketika hidrogen bereaksi dengan logam yang sangat elektropositif, seperti alkali dan alkaliner.
Misalnya, hidrogen bereaksi dengan natrium logam untuk menghasilkan natrium hidrida:
2NA (s) + h2(g) → 2Nah (s)
Atau dengan barium untuk menghasilkan barium hidrida:
BA (S) + H2(g) → bah2(S)
Molekuler
Hidrida molekul bahkan lebih dikenal daripada ionik. Mereka juga menerima nama hidrogen halogenuros, hx, ketika hidrogen bereaksi dengan halogen:
Cl2(g) + h2(g) → 2hcl (g)
Di sini hidrogen berpartisipasi dalam ikatan kovalen sebagai h+; Karena, perbedaan antara elektronegatifitas antara kedua atom tidak terlalu besar.
Air yang sama dapat dianggap sebagai oksigen hidrida (atau hidrogen oksida), yang reaksi pembentukannya sudah terpapar. Sangat mirip adalah reaksi dengan sulfur untuk memberikan hidrogen sulfida, gas bau:
S (S) + H2(g) → H2S (g)
Tetapi dari semua hidror molekul yang paling terkenal (dan mungkin yang paling sulit untuk disintesis) adalah amonia:
N2(g) + 3h2(g) → 2nh3(G)
Aplikasi
Pada bagian sebelumnya, salah satu penggunaan utama hidrogen sudah ditangani: sebagai bahan baku untuk pengembangan sintesis, anorganik atau organik. Mengontrol gas ini biasanya memiliki tujuan lain daripada membuatnya bereaksi untuk membuat senyawa lain berbeda dari yang diekstraksi.
Bahan baku
- Ini adalah salah satu reagen untuk sintesis amonia, yang pada gilirannya memiliki aplikasi industri yang tak ada habisnya, dimulai dengan elaborasi pupuk, sampai sebagai bahan untuk obat nitrogenar.
- Ini dimaksudkan untuk bereaksi dengan karbon monoksida dan dengan demikian menghasilkan metanol, reagen yang tinggi biofuel.
Agen pereduksi
- Ini adalah agen pereduksi oksida logam tertentu, sehingga digunakan dalam reduksi metalurgi (sudah dijelaskan dalam kasus tembaga dan logam lainnya).
- Kurangi lemak atau minyak untuk menghasilkan margarin.
Industri minyak
Dalam industri minyak, hidrogen digunakan untuk "hydrotratar" minyak mentah dalam proses penyempurnaan.
Misalnya, ia berupaya memecah molekul besar dan berat dalam molekul kecil dan dengan permintaan yang lebih besar di pasar (Hydrocracheus); Lepaskan logam yang terperangkap dalam kandang petroporfirin (hydrodesmetalization); menghilangkan atom belerang sebagai h2S (hidrodesulfurisasi); atau mengurangi tautan ganda untuk membuat campuran kaya dalam parafin.
Bahan bakar
Hidrogen itu sendiri adalah bahan bakar yang sangat baik untuk roket atau pesawat ruang angkasa, karena sejumlah kecilnya bereaksi dengan oksigen, mereka melepaskan sejumlah besar panas atau energi.
Pada skala yang lebih kecil, reaksi ini digunakan untuk desain sel atau baterai hidrogen. Namun, sel -sel ini menghadapi kesulitan karena tidak dapat menyimpan gas ini dengan benar; dan tantangan sepenuhnya independen dari pembakaran bahan bakar fosil.
Di sisi positif, digunakan sebagai bahan bakar, hidrogen hanya melepaskan air; Alih -alih gas yang mewakili sarana polusi untuk atmosfer dan ekosistem.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Hanyu Liu, Li Zhu, Wenwen Cui dan Yanming Ma. (S.F.). Struktur suhu kamar hidrogen padat pada tekanan tinggi. Lab Kunci Negara Bagian Superhard Material, Universitas Jilin, Changchun 130012, China.
- Pierre-Marie Robitaille. (2011). Liquid Metallic Hydrogen: Blok bangunan untuk matahari cair. Departemen Radiologi, Universitas Negeri Ohio, 395 W. 12th Ave, Columbus, Ohio 43210, USA.
- Kelompok Bodner. (S.F.). Kimia hidrogen. Diperoleh dari: chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Hidrogen. Diperoleh dari: di.Wikipedia.org
- Hidrogen Eropa. (2017). Aplikasi Hidrogen. Pulih dari: hidrogeneurope.UE
- Foist Laura. (2019). Hidrogen: sifat & kejadian. Belajar. Pulih dari: belajar.com
- Jonas James. (4 Januari 2009). Sejarah hidrogen. Diperoleh dari: Altenergymag.com
- « PICHINCHA Battle Penyebab, konsekuensi dan karakter
- Karakteristik novel pastoral, perwakilan, karya »

