Hidrogenasi Katalitik
- 4185
- 386
- Ray Thiel
 Hidrogenasi katalitik adalah reaksi kimia di mana hasil akhirnya adalah penambahan hidrogen ke senyawa lain. Sumber: Gabriel Bolívar
Hidrogenasi katalitik adalah reaksi kimia di mana hasil akhirnya adalah penambahan hidrogen ke senyawa lain. Sumber: Gabriel Bolívar Apa itu hidrogenasi katalitik?
Itu Hidrogenasi Katalitik Itu adalah reaksi kimia yang dengannya hidrogen molekul ditambahkan dalam senyawa pada kecepatan yang lebih tinggi.
Molekula h2 Pertama -tama harus melanggar ikatan kovalen, tetapi juga, menjadi tabrakan yang begitu kecil dan efisien antara itu dan senyawa ke tempat yang akan ditambahkan lebih kecil kemungkinannya.
Senyawa reseptor hidrogen mungkin organik atau anorganik. Pada senyawa organik di mana ada sebagian besar contoh hidrogenasi katalitik, terutama yang memiliki aktivitas farmakologis, atau memiliki logam yang dimasukkan ke dalam strukturnya (senyawa organometalik).
Saat H ditambahkan2 Ke struktur yang penuh karbon, yang terjadi adalah bahwa tidak jenuhnya berkurang, yaitu karbon mencapai tingkat maksimum tautan sederhana yang dapat dibentuknya.
Oleh karena itu, h2 Tautan ganda (c = c) dan triple (copc) ditambahkan, meskipun juga dapat ditambahkan ke gugus karbon (C = O).
Dengan demikian, alkena dan alkin bereaksi dengan hidrogenasi katalitik. Secara dangkal menganalisis struktur apa pun, dapat diprediksi apakah itu akan menambah atau tidak h2 Deteksi saja tautan ganda dan tiga.
Karakteristik hidrogenasi katalitik
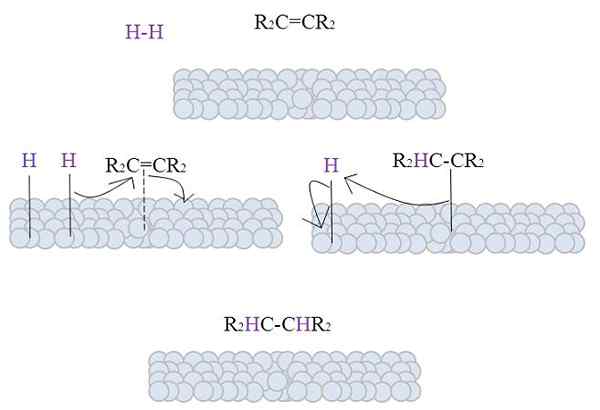
Gambar menunjukkan mekanisme reaksi ini. Namun, perlu untuk mengatasi beberapa aspek teoretis sebelum menggambarkannya.
Permukaan bola abu -abu mewakili atom logam yang, seperti yang akan dilihat, adalah katalis hidrogenasi par excellence.
Ikatan hidrogen pecah
- Hidrogenasi adalah reaksi eksotermik, yaitu, menghilangkan panas sebagai akibat dari pembentukan senyawa energi yang lebih rendah.
Dapat melayani Anda: acetanylide (c8h9no)- Ikatan C-H yang terbentuk stabil, yang membutuhkan energi yang lebih besar untuk pecah selanjutnya daripada ikatan H-H dari kebutuhan hidrogen molekuler.
- Hidrogenasi selalu melibatkan pertama pecahnya tautan H-H. Pecahnya ini bisa bersifat homolitik, seperti dalam banyak kasus:
H-h => h ∙ + ∙ h
Atau heterolitik, yang dapat diberikan, misalnya, ketika seng oksida adalah hidrogen, zno:
H-h => h+ + H-
- Perbedaan antara kedua pecahnya terletak pada bagaimana elektron tautan didistribusikan. Jika mereka didistribusikan secara merata (secara kovalen), masing -masing h akhirnya mempertahankan elektron, sedangkan jika distribusinya ionik, satu berakhir tanpa elektron, h+, Dan yang lain memenangkan mereka sepenuhnya, h-.
- Kedua pecahnya dimungkinkan dalam hidrogenasi katalitik, meskipun homolitik memungkinkan untuk memberi jalan bagi pengembangan mekanisme logis untuk ini.
Eksperimental
- Hidrogen adalah gas, dan oleh karena itu, harus bergelembung dan menjamin bahwa hanya ia mendominasi pada permukaan cairan.
- Senyawa hidrogenar harus dilarutkan dalam medium, baik itu air, alkohol, eter, ester atau amina cair. Kalau tidak, hidrogenasi akan berlalu sangat lambat.
Melarutkan senyawa ke hidrogenar, juga harus ada katalis dalam media reaksi. Ini akan bertanggung jawab untuk mempercepat kecepatan reaksi.
- Dalam hidrogenasi katalitik, logam nikel, paladium, platinum atau rhodium yang terbagi halus biasanya digunakan, yang tidak larut di hampir semua pelarut organik. Oleh karena itu, akan ada dua fase: cairan dengan senyawa terlarut dan hidrogen, dan padatan, yaitu katalis.
Ini dapat melayani Anda: Cruise for Crucible: Karakteristik, Fungsi, Gunakan Contoh- Logam -logam ini menyediakan permukaannya sehingga hidrogen dan senyawa bereaksi, sehingga ikatan dipikirkan.
- Mereka juga mengurangi ruang penyebaran spesies, meningkatkan jumlah tabrakan molekuler yang efektif. Bukan hanya itu, tetapi bahkan reaksinya terjadi di dalam pori -pori logam.
Jenis hidrogenasi katalitik
Homogen
Ada pembicaraan tentang hidrogenasi katalitik yang homogen ketika media reaksi terdiri dari satu fase tunggal. Di sini penggunaan logam di keadaan murni mereka, karena mereka tidak larut.
Sebaliknya, senyawa organometalic dari logam ini digunakan, yang larut, dan telah terbukti memiliki hasil tinggi.
Salah satu senyawa organetalik ini adalah Katalis Wilkinson: Tris klorida (trifenylphin) rodio, [(c6H5)3P]3Rhcl.
Senyawa ini membentuk kompleks dengan h2, Mengaktifkannya untuk penambahan selanjutnya ke alkena atau Alquino.
Hidrogenasi yang homogen menghadirkan lebih banyak alternatif daripada heterogen, karena kimia dalam senyawa organometalik berlimpah: cukup untuk mengubah logam (PT, PD, RH, Ni) dan ligan (molekul organik atau anorganik yang terkait dengan pusat logam), ke Dapatkan katalis baru.
Heterogen
Heterogen Katalitik Hidrogenasi, seperti yang baru saja disebutkan, memiliki dua fase: satu cairan dan satu padatan.
Selain katalis logam, ada orang lain yang terdiri dari campuran padat. Misalnya, katalis lindlar, yang terdiri dari platinum, kalsium karbonat, timbal asetat dan quinoline.
Katalis Lindlar memiliki kekhasan bahwa itu buruk untuk hidrogenasi alkena. Namun, ini sangat berguna untuk hidrogenasi parsial, yaitu, ia bekerja dengan sangat baik pada alkine:
Dapat melayani Anda: lutecio: struktur, sifat, penggunaan, mendapatkanRCHCR + H2 => Rhc = chr
Mekanisme
Gambar menunjukkan mekanisme hidrogenasi katalitik menggunakan logam bubuk sebagai katalis.
Bola abu -abu sesuai dengan permukaan logam, untuk mengatakan, platinum. Molekul h2 (warna ungu) dekat dengan permukaan logam, serta pengganti tetra alkene, r2C = Cr2.
H2 Interaksi dengan elektron yang menempuh atom logam, dan istirahat dan pembentukan tautan temporal H-M terjadi, di mana m adalah logam. Proses ini dikenal sebagai chemisorpsi. Yaitu, adsorpsi oleh kekuatan kimia.
Alkene berinteraksi dengan cara yang sama, tetapi tautan membentuknya dengan ikatan rangkap (garis putus -putus).
Ikatan H-H telah dipisahkan dan setiap atom hidrogen tetap terkait dengan logam. Demikian pula, ia melakukannya dengan pusat logam dalam katalis organetalik, membentuk kompleks perantara H-M-H.
Itu kemudian terjadi migrasi H ke ikatan rangkap, dan ini terbuka membentuk tautan dengan logam. Kemudian, H yang tersisa bergabung dengan karbon lain dari ikatan rangkap asli, dan alkana yang diproduksi akhirnya dilepaskan, r2HC-CHR2.
Mekanisme ini akan diulang sebanyak yang diperlukan, sampai semua h2 benar -benar bereaksi.
Referensi
- Carey, f. (2008). Kimia organik. MC Graw Hill.
- Shiver & Atkins (2008). Kimia anorganik. MC Graw Hill.
- Lew, J. (S.F.). Hidrogenasi katalitik alkena. Kimia pulih.Librettexts.org
- Apa itu hidrogenasi katalitik? - Mekanisme & Reaksi. Studi pulih.com

