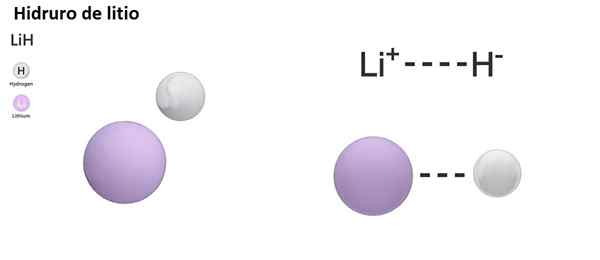Hidror
- 3865
- 751
- Mr. Darrell Streich
Apa itu Hydruros?
Hydros adalah senyawa kimia yang dihasilkan dari reaksi hidrogen dengan elemen logam (natrium, kalium, kalsium, dll.) dan bukan logam (klorin, fluor, oksigen, nitrogen, karbon, dll.). Hidrogen bereaksi dengan hampir semua elemen kimia, jadi hidror adalah zat yang sangat beragam.
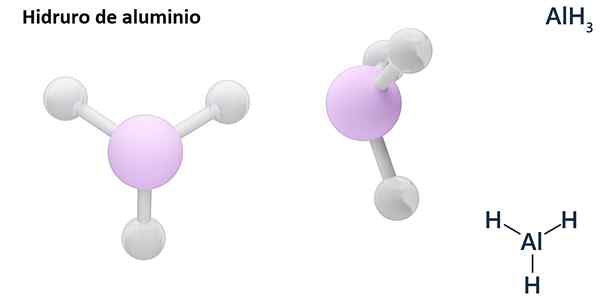
Rumus umumnya bisa menjadi tipe MHN, Dimana m adalah logam dan N Valencia -nya (+1, +2, +3), seperti aluminium hidrida, ALH3; atau tipe ehN atau hNDan, di mana E adalah elemen non -metalik dan N Valencia -nya, seperti NH3 atau h2S.
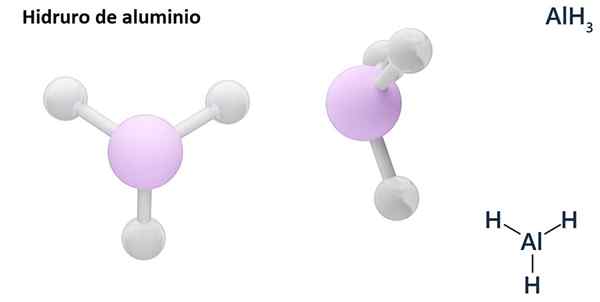
Hydros biasanya senyawa biner, yaitu, hasilnya dari kombinasi hidrogen dengan elemen kimia lainnya. Namun, hidrogen juga dapat menetapkan kombinasi dengan beberapa elemen kimia, untuk membentuk hidror yang lebih kompleks. Semua hidror yang dijelaskan akan menjadi biner, seperti ALH3 dan nah.
Ada tiga jenis hidror sesuai dengan sifat ikatan kimianya: ionik, molekuler dan logam. Hidror ionik atau salin ditandai dengan adanya ikatan ionik. Tautan ini terdiri dari daya tarik listrik antara beban positif logam alkali (NA+) atau alkali-bundel (mg2+), dan beban negatif anion hidrida (h-).
Hidrida molekul, di sisi lain, ditandai dengan pembentukan ikatan kovalen antara hidrogen dan elemen non -metalik. Di antara elemen non -metalik yang membentuk hidro adalah: klorin, bromin, fluor, yodium, oksigen dan nitrogen.
Dan hidror logam dihasilkan dari kombinasi hidrogen dengan beberapa logam transisi. Jenis hidrida ini, tidak seperti yang sebelumnya, memiliki struktur yang kompleks dan tidak akan dijelaskan di sini.
Sifat hidros
Sifat -sifat hydrurn bervariasi tergantung pada jenis hidrida: ionik, molekul atau logam, sehingga sifatnya harus diindikasikan secara terpisah.
Hidror ionik atau garam
Mereka adalah padatan putih kristal, tetapi karena adanya kotoran mereka memperoleh warna keabu -abuan. Hidrida ini tidak larut dalam pelarut umum, seperti air, alkohol, dll. Mereka juga memiliki titik mendidih dan fusi yang tinggi.
Mereka memiliki kepadatan keadaan tinggi dan cair dapat menghantarkan listrik.
Hydurn ionik dianggap dasar atau basa, karena dilarutkan dalam air bentuk hidroksida dan melepaskan hidrogen molekuler:
Nah +h2O → h2 + Naoh
Reaksi hidrida ionik dengan air sangat kuat dan berbahaya: menghasilkan hidrogen dalam bentuk gas, yang merupakan bahan yang mudah terbakar dan mudah terbakar.
Hydurn ionik juga dapat bereaksi dengan logam halida, dibentuk oleh logam dan non -logam yang dikenal sebagai halogen (mx, x = f, cl, br, i):
Dapat melayani Anda: dimethlanylin: struktur, sifat, sintesis, penggunaan4 LIH +ALCL3 → Lialh4 + 3 LICL
LIH (lithium hidrida) adalah senyawa biner; sedangkan lialh4 (Lithium dan aluminium hidrida) adalah senyawa terner, yaitu, terdiri dari tiga elemen kimia.
Hidro molekuler atau kovalen
Mereka berada dalam keadaan cair atau gas tidak seperti hidror ionik, yang padat. Mereka memiliki titik mendidih dan fusi yang rendah, mengamati bahwa dengan meningkatkan berat molekul hidrida, titik didih meningkat; Kecuali amonia (NH3), Air (h2O) dan fluoride hydride (HF).
Hidrida kovalen adalah konduktor listrik yang buruk dan banyak sifatnya disebabkan oleh pembentukan jembatan hidrogen. Hidrida kovalen dianggap sebagai asam, karena dilarutkan dalam air dapat menyebabkan asam, misalnya, asam klorida.
Hidror logam
Mereka berada dalam keadaan solid, menghadirkan nada gelap logam. Mereka adalah konduktor listrik yang baik dan memiliki permukaan berkilau. Hidrida logam yang stabil di udara menjadi reagen saat memanas, misalnya, uranium hidrida (eh3) Menyajikan properti ini.
Tata nama
Cara untuk menamai hidror itu sederhana, dan tidak terlalu bervariasi di salah satu nomenklatif. Jika logam atau elemen logam memiliki lebih dari satu valensi, itu ditentukan dalam tanda kurung dan dengan nomor Romawi sesuai dengan nomenklatur stok.
Misalnya, feh3 disebut besi hidrida (III), dan COH2 Cobalt Hydro (II). Hidrida yang sama ini juga dapat ditunjuk menggunakan nomenklatur sistematis, yang memanfaatkan angka Yunani (DI, TRI, Tetra, dll.). Jadi, feh3 disebut besi trihidrida, dan coh2 kobalt dihydruro.
Nomenklatur klasik tidak banyak digunakan untuk hidro. Misalnya, Nah lebih dikenal sebagai natrium hidrida, dan bukan natrium hidrida.
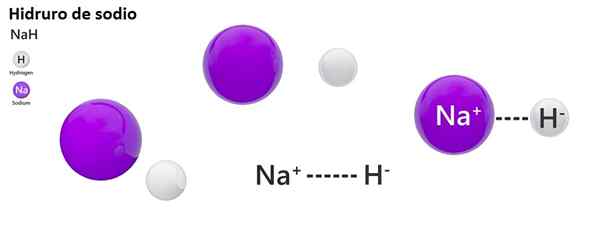 Sodium hidrida
Sodium hidrida Bagaimana Hydros terbentuk?
Hidror ionik atau garam
Mereka dibentuk oleh reaksi hidrogen dengan logam yang termasuk dalam kelompok logam alkali atau kelompok logam alkali-terero.
Dalam hidror yang dilatih dengan logam ini, hidrogen ditemukan dalam bentuk H-, dikenal sebagai anion hidrida.
Logam alkali (lithium, natrium, kalium, rubidium, dan cesium) bereaksi dengan hidrogen untuk membentuk hidung yang sesuai:
2 m (l)+h2(g) → 2mh (s)
Dapat melayani Anda: operasi unitLogam m Saat bereaksi dalam keadaan cair, dan hidrogen dalam keadaan gas, sehingga reaksi membutuhkan suhu tinggi dan tekanan tinggi. Pertimbangkan contoh berikut:
2 li (l) +h2 (g) → 2 LIH (S)
Reaksi hidrogen dengan logam basa-ketiga (berilium, magnesium, kalsium, strontium dan barium), untuk pembentukan hidrida, mirip dengan yang diamati dengan logam alkali alkali.
Magnesium dan berilium membentuk hidrida, tetapi ikatannya dengan hidrogen adalah tipe kovalen; Yaitu, non -ionik, tidak seperti logam alkali lainnya:
Ca (l) +h2 (g) → CAH2 (S)
Hidror molekul
Hidrogen dapat bereaksi dengan non -logam, sesuai dengan kelompok 14, 15, 16 dan 17 dari tabel periodik, untuk membentuk hidror molekul. Pertimbangkan, misalnya, pembentukan fluorida hidrida dengan kombinasi atau campuran langsung hidrogen dengan fluor:
H2 (g) +f2 (g) → 2 hf (g)
HF lebih dikenal sebagai hidrogen fluoride, tetapi juga disebut fluoride hydride.
Juga, hidrogen dapat bereaksi dengan oksigen (kelompok 16 dari tabel periodik) mengikuti skema yang sama:
2 h2 (g) +atau2 (g) → 2 jam2O (g)
Reaksi membutuhkan suplai panas untuk menghasilkan hidrogen oksida (air) atau oksigen hidrida.
Juga, hidrogen dapat bereaksi dengan nitrogen, milik kelompok 15 dari tabel periodik untuk membentuk nitrogen hidrida, lebih dikenal sebagai amonia (NH3).
N2 (g) +3 h2 (g) → 2 nh3 (G)
Reaksi membutuhkan pasokan panas, tekanan tinggi dan adanya katalis (mereka mempercepat reaksi kimia).
Hidror logam
Mereka dibentuk oleh reaksi logam transisi (kelompok 3, 4, 5, 6, 10, 11 dan 12 dari tabel periodik) dengan hidrogen. Namun, logam transisi kelompok 7, 8 dan 9 tidak membentuk senyawa dengan hidrogen, fenomena yang dikenal sebagai celah hidrida atau celah hidrida.
Karakteristik unik dari hidror logam transisional adalah bahwa mereka tidak selalu menghadirkan proporsi tetap antara jumlah atom hidrogen dan jumlah atom yang ada dalam hidrida. Yaitu, formula dan struktur mereka tidak mudah diwakili.
Penggunaan/Aplikasi Hydros
 Hydros sangat hadir di salah satu dari banyak jenis baterai: seperti NIMH. Sumber: multicherry, cc by-sa 4.0, via Wikimedia Commons
Hydros sangat hadir di salah satu dari banyak jenis baterai: seperti NIMH. Sumber: multicherry, cc by-sa 4.0, via Wikimedia Commons Hidros ada dalam baterai hidrida logam nikel (NIMH), digunakan bersama dengan logam tanah jarang, kobalt atau mangan. Beberapa hidror logam telah diperiksa untuk digunakan dalam mobil listrik yang digerakkan oleh sel yang berhubungan dengan hidrogen.
Dapat melayani Anda: metode keseimbangan redoks: langkah, contoh, latihanAgen pereduksi
Lithium hidrida dan natrium boron (nabh4) Mereka digunakan sebagai reaksi kimia dalam reaksi sintesis organik.
Penyimpanan hidrogen dan penggunaan terkait lainnya
Ada pilot penggunaan hidrogen sebagai bahan bakar pada kendaraan bermotor, tetapi karena ledakannya, penggunaannya terbatas sebagai bahan bakar. Penggunaan hidros telah diusulkan sebagai bentuk penyimpanan hidrogen, dengan demikian mengendalikan bahaya mereka.
Selain itu, hidror telah digunakan untuk pemurnian dan pemisahan sensor hidrogen dan suhu.
Desiccants
Kalsium hidrida digunakan untuk menghilangkan air yang ada dalam pelarut organik.
Asam berasal dari hidror molekul
Sebagai contoh: asam klorida dibentuk oleh larutan dalam media berair klorin hidrida (HCl), menggunakan asam klorida dalam penghapusan oksida yang menutupi zat besi, pengasaman sumur minyak, produksi klorida kalsium dan perawatan mineral.
Pupuk
Amonia (NH3) Ini adalah hidrida yang digunakan sebagai pupuk cair dan disajikan untuk sintesis senyawa dengan amonium nitrat dan amonium sulfat, yang digunakan sebagai pupuk.
Air
Adalah hidrida terpenting. Ini digunakan di banyak industri dengan berbagai kegunaan dan aplikasi. Air adalah yang utama yang bertanggung jawab atas keberadaan makhluk hidup.
Contoh hidror
Akhirnya, contoh hidror lainnya akan terdaftar dengan formula dan nama masing -masing:
SNH4: Tin Hydride | PH3: Fosfor hidrida (fosfin) atau fosfor trihidrida |
KH: Timbal hidrida | MGH2: magnesium hidrida atau magnesium dihydruro |
KH: Kalium hidrida | CH4: Carruro Carruro atau Carbon Tetrahydride (Metana) |
Cah2: kalsium hidrida | FEH2: Besi hidrida (II) |
Nah: natrium hidrida | ZnH2: Seng Hydride |
LIH: Lithium Hydride | Bah2: Barium hydride |
CSH: Cesium Hydride | BH3: Boron Hydro (BAS |
Beh2: Beryl atau Beryl Dihydride Hydride | SIH4: Silicon Hydro (Silan) |
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wojes, Ryan. (27 Agustus 2020). Apa itu logam hidrida? Pulih dari: thinkco.com
- Elemen Amerika. (2020). Hidridida. Diperoleh dari: Amerika.com
- Wikipedia. (2020). Hidrida. Diperoleh dari: di.Wikipedia.org
- Tandis Arani. (15 Agustus 2020). Hidridida. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Para editor Eeritlopaedia Britannica. (2020). Hidrida. Dipulihkan dari: Britannica.com