Struktur magnesium hidroksida, sifat, nomenklatur, penggunaan

- 1607
- 41
- Pete Lesch
Dia Magnesium hidroksida Ini adalah senyawa anorganik yang formula kimianya adalah Mg (OH)2. Dalam bentuk murni itu adalah padatan putih tanpa kecerahan dan penampilan amorf; Namun, dengan kandungan kotoran yang kecil dan akurat diubah menjadi brucita padat kristal, mineral yang ada di endapan tertentu di alam, dan merupakan sumber magnesium yang kaya.
Ini adalah elektrolit atau dasar yang lemah, sehingga disosiasi rendah air. Properti ini membuat MG (OH)2 penetral keasaman yang baik untuk konsumsi manusia; Obat populer yang dikenal sebagai suspensi susu dari magnesia. Ini juga merupakan penghambat api dengan melepaskan air selama dekomposisi termal.
 Sampel magnesium hidroksida padat. Sumber: ChemicalInterest [domain publik]
Sampel magnesium hidroksida padat. Sumber: ChemicalInterest [domain publik] Pada gambar atas beberapa padatan magnesium hidroksida ditampilkan, di mana warna putihnya yang buram dapat terlihat. Semakin banyak kristal, mereka mengembangkan permukaan kaca dan mutiara.
Struktur kristalnya aneh karena membentuk kristal heksagonal pelapis ganda, yang merupakan desain yang menjanjikan untuk desain bahan baru. Dalam lapisan ini, beban positif mereka memainkan peran penting karena penggantian MG2+ oleh kation trivalen, dan untuk spesies yang terbatas di antara dinding yang terdiri dari anion OH-.
Di sisi lain, aplikasi lain berasal tergantung pada morfologi partikel atau nanopartikel yang disiapkan; sebagai katalis atau adsorben. Dalam semuanya, rasio 1: 2 untuk ion Mg adalah konstan2+: Oh-, tercermin dalam formula MG yang sama (OH)2.
[TOC]
Struktur
Formula dan Octaedro
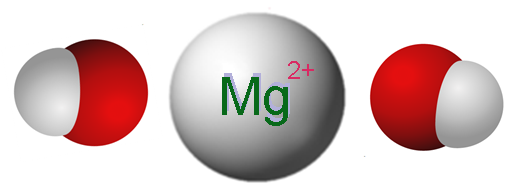 Ion yang membentuk magnesium hidroksida. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Ion yang membentuk magnesium hidroksida. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Gambar superior menunjukkan ion yang membentuk MG (OH)2. Seperti yang bisa dilihat, ada dua anion oh- Untuk setiap kation mg2+, yang berinteraksi secara elektrostatik untuk mendefinisikan kristal struktur heksagonal. Rumus yang sama menunjukkan bahwa rasio mg: oh adalah 1: 2.
Namun, struktur kristal sejati sedikit lebih rumit daripada mengasumsikan ion Mg sederhana2+ dan oh-. Sebenarnya, magnesium ditandai dengan memiliki jumlah koordinasi 6, sehingga dapat berinteraksi dengan hingga enam oh-.
Dengan demikian, Octahedron Mg (OH) terbentuk6, dimana atom oksigen jelas berasal dari oh-; dan struktur kristal sekarang bertumpu pada pertimbangan octahedra seperti itu dan bagaimana mereka berinteraksi satu sama lain.
Faktanya, unit MG (OH)6 Mereka akhirnya mendefinisikan struktur peluncur ganda yang, pada gilirannya, diperintahkan di ruang untuk menyebabkan kaca heksagonal.
Dapat melayani Anda: berat atomDua lapisan
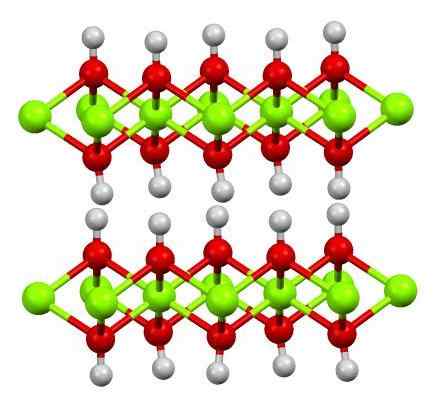 Lapisan ganda magnesium hidroksida. Sumber: Smokefoot [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Lapisan ganda magnesium hidroksida. Sumber: Smokefoot [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Gambar atas menunjukkan lapisan ganda magnesium hidroksida (LDH) Hidroksida ganda berlapis). Bola hijau mewakili ion MG2+, yang dapat digantikan oleh orang lain dengan beban yang lebih besar untuk menghasilkan beban positif di lapisan.
Perhatikan bahwa di sekitar setiap mg2+ Ada enam bidang merah yang terhubung ke bola putih masing -masing; yaitu unit oktahedral mg (oh)6. OH- Itu bertindak sebagai jembatan untuk bergabung dengan dua mg2+ bidang yang berbeda, yang membuat lapisan dikurung.
Demikian juga, diamati bahwa atom hidrogen menunjuk ke atas dan ke bawah, dan merupakan yang pertama bertanggung jawab untuk kekuatan antarmolekul untuk menjaga dua lapisan unit Mg (OH) bersama -sama6.
Di antara lapisan -lapisan ini, molekul netral (seperti alkohol, amonia dan nitrogen) atau bahkan anion, tergantung pada seberapa positif mereka (jika ada ion3+ atau iman3+ mengganti MG2+). "Pengisian" spesies ini dibatasi oleh permukaan yang terdiri dari anion OH-.
Morfologi
Kaca heksagonal dan ganda -layer tumbuh perlahan atau cepat. Itu semua tergantung pada parameter sintesis atau persiapan: suhu, hubungan molar, agitasi, pelarut, reagen sebagai sumber magnesium, basa atau agen endapan, dll. Saat kaca tumbuh, tentukan struktur mikro atau morfologi nanopartikel atau agregatnya.
Dengan demikian, nanopartikel ini dapat memiliki piring, trombosit, atau kembang kol. Demikian juga, distribusi ukurannya dapat berubah, serta tingkat porositas padatan yang dihasilkan.
Properti
Penampilan fisik
Ini adalah padatan putih, granulasi atau bubuk, dan toilet.
Masa molar
58.3197 g/mol.
Kepadatan
3.47 g/ml.
Titik lebur
350 ºC. Pada suhu ini ia rusak dalam oksida dengan melepaskan molekul air yang terkandung dalam kristal:
Mg (oh)2(s) => mgo +h2O (g)
Kelarutan air
0,004 g/100 mL pada 100 ° C; Artinya, hampir tidak berhasil larut dalam air mendidih, jadi itu adalah senyawa yang tidak larut dalam air. Namun, dengan mengurangi pH (atau peningkatan keasaman) kelarutannya meningkat dengan pembentukan acuo kompleks, mg (oh2)6.
Di sisi lain, jika mg (oh)2 telah menyerap co2, akan melepaskan gas yang ditahan sebagai effervescence saat melarutkan dalam medium asam.
Dapat melayani Anda: helium: sejarah, sifat, struktur, risiko, penggunaanIndeks bias
1.559
ph
Suspensi berairnya memiliki pH yang bervariasi antara 9,5 dan 10,5. Meskipun nilai -nilai ini normal, ia mencerminkan kebesaran kecilnya terhadap hidroksida logam lainnya (seperti NaOH).
Kapasitas panas
77.03 J/mol · k
Di mana letaknya?
 Blue Brucita Blue Blut. Sumber: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Blue Brucita Blue Blut. Sumber: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Magnesium hidroksida dapat ditemukan di alam sebagai mineral Brucita, yang ditandai dengan warna putih transparannya, dengan nada hijau atau kebiruan tergantung pada kotorannya. Demikian juga, brucita adalah bagian dari beberapa lempung, seperti klorit, ketika diseling -antara di antara lapisan silikat, bergabung dengan ion logam.
Di La Brucita ada ion lain selain MG2+, seperti al3+, Keyakinan3+, Zn2+ dan MN2+. Menas mereka dapat ditemukan di berbagai daerah atau danau Skotlandia, Kanada, Italia dan AS.
Secara fisik kristal mereka melihat.
Mineral ini adalah salah satu kejahatan yang memengaruhi semen dan beton, karena cenderung berkembang dan menyebabkan patah tulang di dalamnya. Namun, itu tidak menyerap CO2, Jadi kalsinasi tidak berkontribusi pada efek rumah kaca dan, oleh karena itu, merupakan sumber mineralogi yang tepat (dan terkaya) untuk mendapatkan magnesium, selain air laut.
Tata nama
MG (oh)2 Ini memiliki hingga tiga nama yang diterima oleh IUPAC (di luar mineralogi atau kedokteran). Ini sangat mirip satu sama lain, karena sama seperti halnya mereka berakhir.
Misalnya, 'magnesium hidroksida' sesuai dengan namanya sesuai dengan nomenklatur stok, menghilangkan (ii) pada akhirnya karena +2 hampir secara default merupakan satu -satunya keadaan oksidasi magnesium.
'Magnesium dihydroxide', menunjuk dengan awalan pembilang Yunani jumlah ion OH- ditunjukkan dalam rumus sesuai dengan nomenklatur sistematis. Dan 'magnetik hidroksida', diakhiri dengan akhiran -ICO untuk menjadi keadaan oksidasi magnesium maksimal dan unik ", menurut nomenklatur tradisional.
Nama -nama lain, seperti Brucita atau Magnesia Milk, meskipun secara langsung terkait dengan senyawa ini, tidak nyaman untuk merujuknya ketika menyangkut padatan paling murni, atau sebagai senyawa anorganik (reagen, bahan baku, dll.).
Aplikasi
Penetral
MG (oh)2 Karena rendahnya kelarutan dalam air fakta bahwa itu adalah penetral keasaman yang sangat baik; Kalau tidak, media akan didasarkan saat berkontribusi besar konsentrasi ion OH-, seperti basis lain (elektrolit kuat).
Dapat melayani Anda: hibridisasi kimiaJadi, MG (OH)2 Hampir tidak melepaskan oh-, Pada saat yang sama bereaksi dengan ion H3SALAH SATU+ Untuk membentuk kompleks magnesium, juga disebutkan di atas. Mampu menetralkan keasaman media berair, itu ditakdirkan untuk pengolahan air limbah.
Ini juga merupakan aditif makanan, pupuk, dan produk -produk kebersihan pribadi tertentu, seperti pasta gigi, karena keasamannya berkurang.
Antasid
Menjadi sedikit air larut, itu bisa diambil tanpa berisiko dari efek ion OH -nya- (Sangat sedikit disosiasi seperti elektrolit lemah).
Karakteristik ini, terkait dengan sub bagian dari atas, membuatnya antasid untuk mengobati keasaman lambung, penyakit pencernaan, gangguan pencernaan dan sembelit, dijual di bawah formula susu magnesia.
Di sisi lain, susu magnesia juga membantu memerangi fasies yang menjengkelkan (luka putih dan merah yang muncul di mulut).
Retardant Api
Di bagian Properties, disebutkan bahwa MG (OH)2 Itu memecah air melepaskan air. Justru, air semacam itu membantu menghentikan kemajuan api, karena mereka menyerap panas untuk menguapkan dan, pada gilirannya, uap uap encer gas yang mudah terbakar atau mudah terbakar.
Mineral Brucita biasanya digunakan secara industri untuk tujuan ini, dimaksudkan sebagai mengisi bahan -bahan tertentu, seperti plastik polimer yang berbeda (PVC, resin, karet), kabel atau langit -langit.
Katalisator
MG (oh)2 disintesis sebagai nanoplaquetas telah terbukti efisien untuk mengkatalisasi pengurangan kimia; Misalnya, 4-nitrofenol (ph-no2) A 4-aminophenol (pH-NH2). Mereka juga memiliki aktivitas antibakteri, sehingga dapat digunakan sebagai agen terapi.
Adsorben
Beberapa mg (oh) padatan2 Mereka bisa cukup keropos, tergantung pada metode persiapan mereka. Oleh karena itu, mereka menemukan aplikasi sebagai adsorben.
Dalam larutan berair mereka dapat menyerap (pada permukaannya) molekul pewarnaan, mengklarifikasi air. Misalnya, mereka dapat menyerap pewarna carmine indigo yang ada dalam arus air.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Magnesium hidroksida. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2019). Magnesium hidroksida. Database pubchem. CID = 14791. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Galeri Amethyst. (2014). Brucite mineral. Pulih dari: galeri.com
- Henrist et al. (2003). Studi morfologis nanopartikel magnesium hidroksida
- Terpencil dalam larutan encer. Jurnal Pertumbuhan Kristal 249, 321-330.
- Saba J., Shanza R. K., Muhammad r. S. (2018). Sintesis dan analisis struktural nanopartikel magnesium hidroksida mesopori sebagai katalis yang efisien.
- Thimmasandra Narayan Ramesh dan Vani Pavada Sreenivasa. (2015). Penghapusan pewarna carmine indigo dari larutan berair menggunakan magnesium hidroksida sebagai adsorben. Jurnal Bahan, Vol. 2015, ID Artikel 753057, 10 halaman. doi.org/10.1155/2015/753057
- « Sejarah Nikel, Properti, Struktur, Penggunaan, Risiko
- Biografi Kamar Pellicer Carlos, gaya, karya, frasa »

