Interaksi hidrofobik apa, pentingnya, contoh
- 4569
- 324
- Miss Wm Hudson
Itu Interaksi hidrofobik (HI) Mereka adalah kekuatan yang mempertahankan kohesi antara senyawa apolar yang direndam dalam larutan polar atau pelarut. Tidak seperti interaksi non-kovalen lainnya, seperti jembatan hidrogen, interaksi ionik atau gaya van der Waals, interaksi hidrofobik tidak tergantung pada sifat intrinsik zat terlarut, melainkan pada pelarut.
Contoh yang sangat ilustratif dari interaksi ini dapat menjadi pemisahan fase yang terjadi ketika datang untuk mencampur air dengan minyak. Dalam hal ini, molekul minyak "berinteraksi" satu sama lain sebagai akibat dari pemesanan molekul air di sekitarnya.
 Emulsi Lemak dalam Air (Catrin Sohrabi [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)], dari Wikimedia Commons)
Emulsi Lemak dalam Air (Catrin Sohrabi [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)], dari Wikimedia Commons) Gagasan interaksi ini ada sejak sebelum empat puluhan. Namun, istilah "hubungan hidrofobik" diciptakan oleh Kauzmann pada tahun 1959, saat mempelajari faktor -faktor terpenting dalam stabilisasi struktur tiga dimensi protein tertentu.
Itu adalah interaksi non -spesifik terpenting yang terjadi dalam sistem biologis. Mereka juga memiliki peran penting dalam berbagai aplikasi teknik dan industri kimia dan farmasi yang kita ketahui saat ini.
Penyebab interaksi hidrofobik
Penyebab fisiknya didasarkan pada ketidakmampuan zat apolar membentuk ikatan hidrogen dengan molekul air dalam suatu larutan.
Mereka dikenal sebagai "interaksi yang tidak spesifik" karena mereka tidak terkait dengan afinitas antara molekul zat terlarut, tetapi lebih dengan kecenderungan molekul air untuk mempertahankan interaksi mereka sendiri dengan menggunakan ikatan hidrogen.
Dapat melayani Anda: biosurfaktanSetelah kontak dengan air, molekul apolar atau hidrofobik cenderung menambahkan secara spontan, untuk mencapai stabilitas yang lebih besar dengan mengurangi area permukaan kontak dengan air.
Efek ini bisa dikacaukan dengan ketertarikan yang kuat, tetapi tidak lebih dari konsekuensi dari karakter apolar zat dalam kaitannya dengan pelarut.
Dijelaskan dari sudut pandang termodinamika, asosiasi spontan ini terjadi untuk mencari keadaan yang menguntungkan secara energik, di mana Anda memiliki variasi energi paling sedikit (∆G).
Dengan mempertimbangkan ∆G = ∆H - T∆S, Keadaan yang paling menguntungkan secara energik adalah di mana entropi (∆S) Lebih besar, yaitu, di mana ada lebih sedikit molekul air yang kebebasan rotasi dan translasi dikurangi melalui kontak dengan zat terlarut apolar.
Ketika molekul apolar dikaitkan satu sama lain, dipaksa oleh molekul air, keadaan yang lebih menguntungkan diperoleh daripada jika molekul ini tetap dipisahkan, masing -masing dikelilingi oleh "kandang" dari berbagai molekul air yang berbeda.
Kepentingan biologis
Nya memiliki relevansinya, karena mereka terjadi dalam keragaman proses biokimia.
Di antara proses -proses ini adalah perubahan konformasi dalam protein, penyatuan substrat enzim, hubungan subunit kompleks enzimatik, agregasi dan pembentukan membran biologis, stabilisasi protein dalam larutan air dan lainnya.
Dalam istilah kuantitatif, penulis yang berbeda telah memberikan tugas untuk menentukan apa pentingnya dirinya dalam stabilitas struktur protein dalam jumlah besar, menyimpulkan bahwa interaksi ini berkontribusi lebih dari 50 %.
Itu dapat melayani Anda: oksidase glukosa: karakteristik, struktur, fungsiBanyak protein membran (integral dan perifer) dikaitkan dengan lipid bilayers berkat Hi ketika, dalam strukturnya, protein ini memiliki domain hidrofobik. Selain itu, stabilitas struktur tersier dari banyak protein terlarut tergantung pada HI.
Beberapa teknik dalam studi biologi sel mengeksploitasi properti yang beberapa deterjen ionik pos.
Mikel juga digunakan dalam studi farmasi yang melibatkan pengiriman obat yang larut dalam lemak dan pembentukannya juga penting untuk penyerapan vitamin dan lipid yang kompleks dalam tubuh manusia.
Contoh interaksi hidrofobik
Membran
Contoh HI yang sangat baik adalah pembentukan membran sel. Struktur seperti itu terdiri dari bilayer fosfolipid. Organisasi Anda diberikan terima kasih kepada miliknya yang terjadi antara ekor apolar dalam "tolakan" ke lingkungan berair di sekitarnya.
Protein
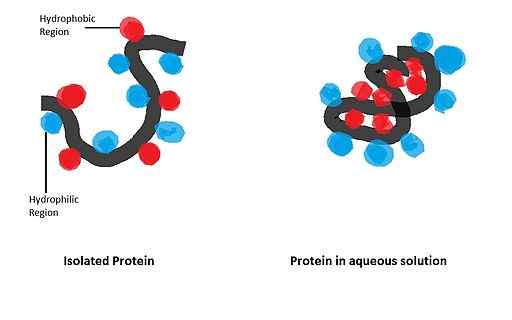
Dia memiliki pengaruh besar pada lipatan protein globular, yang bentuknya aktif secara biologis diperoleh setelah pembentukan konfigurasi spasial tertentu, diatur oleh adanya limbah asam amino tertentu dalam struktur.
- Kasus apomioglobin
Apomicoglobin (mioglobin yang tidak memiliki kelompok hemo) adalah protein alfa-helikoid kecil yang telah berfungsi sebagai model untuk mempelajari proses lipat dan pentingnyanya di antara limbah apolar dalam rantai polipeptida yang sama.
Dalam sebuah penelitian yang dilakukan oleh Dyson dan kolaborator pada tahun 2006 di mana urutan apomioglobin yang bermutasi digunakan, ditunjukkan bahwa inisiasi peristiwa lipat ini tergantung terutama pada asam amino dengan kelompok apolar dari heliks alfa alfa.
Itu dapat melayani Anda: hubungan antara materi dan energi yang diamati dalam nutrisi selDengan demikian, perubahan kecil yang diperkenalkan dalam urutan asam amino berarti modifikasi penting dalam struktur tersier, yang menghasilkan protein yang tidak terbentuk dan tidak aktif dengan buruk.
Deterjen
Contoh lain yang jelas dari miliknya adalah cara tindakan deterjen komersial yang kami gunakan untuk tujuan rumah tangga setiap hari.
Deterjen adalah molekul amphipatic (dengan daerah kutub dan apolar lainnya). Mereka dapat "mengemulsi" lemak karena mereka memiliki kemampuan untuk membentuk ikatan hidrogen dengan molekul air dan memiliki interaksi hidrofobik dengan lipid yang ada dalam lemak.
Setelah kontak dengan lemak ke dalam larutan berair, molekul deterjen berhubungan satu sama lain sedemikian rupa sehingga ekor apolar menghadap, melampirkan molekul lipid, dan terpapar ke permukaan Mycela daerah kutub, yang masuk ke dalam kontak air.
Referensi
- Chandler, d. (2005). Antarmuka dan kekuatan pendorong perakitan hidrofobik. Alam, 437(7059), 640-647.
- Dyson, J. H., Wright, hlm. DAN., & Sheraga, h. KE. (2006). Peran interaksi hidrofobik dalam inisiasi dan perambatan lipatan protein. PNA, 103(35), 13057-13061.

