Konsep isoterm adsorpsi, jenis, contoh

- 1580
- 248
- Joseph Nader PhD
Itu Isoterm adsorpsi Mereka adalah representasi grafis dari perilaku partikel yang teradsorpsi, pada permukaan padatan atau cairan, ketika konsentrasinya meningkat. Jika partikel yang teradsorpsi sesuai dengan gas, maka tekanannya diperhitungkan.
Dengan mengamati isoterm ini, sebuah gagasan tentang bagaimana proses adsorpsi terjadi dapat diambil; Dan oleh karena itu, bagaimana interaksi permukaan partikel, dan karakteristik permukaan. Menganalisis isoterm disimpulkan jika permukaannya halus, berpori, atau mikropor, serta kemungkinan kondensasi.
 Komponen yang diperlukan untuk grafik atau konstruksi isoterm adsorpsi. Sumber: Gabriel Bolívar.
Komponen yang diperlukan untuk grafik atau konstruksi isoterm adsorpsi. Sumber: Gabriel Bolívar. Gambar superior membantu untuk memperjelas yang disebutkan di atas. Partikel yang teradsorpsi (lingkaran ungu) adalah adsorbat yang disebut SO. Sedangkan adsorben adalah area yang memiliki area di mana adsorbat akan diadsorpsi. Seiring meningkatnya tekanan atau konsentrasi Anda, semakin besar volume yang teradsorpsi di atas adsorben.
Representasi sederhana ini sesuai dengan adsorpsi yang dijelaskan oleh isoterm tipe I. Menggunakan isoterm, adsorpsi gas atau infinitas cair pada gel, padatan atau katalis dipelajari.
[TOC]
Jenis Isoterm Adsorpsi
 Isoterm adsorpsi untuk sistem gas-padat. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0)
Isoterm adsorpsi untuk sistem gas-padat. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0) Lima dari isoterm eksperimental utama yang digunakan oleh S ditunjukkan di atas. Brunauer untuk mengklasifikasikan partikel gas pada padatan. Masing -masing menggambarkan proses adsorpsi yang berbeda. Juga, masing -masing memiliki model matematika yang berupaya menyimpulkan perilaku kurva.
Tidak ada yang tidak ada unit atau variabel yang digunakan dalam sumbu x (p/po) dan y (x), sumbu x menunjukkan berapa banyak tekanan atau konversi "tindakan" adsorbat pada padatan; Sementara sumbu y, mengatakan berapa banyak adsorbat itu benar -benar teradsorpsi pada permukaan padatan atau adsorben tersebut.
Itu dapat melayani Anda: tembaga sulfat (cuso4): struktur, sifat, mendapatkan, menggunakanDengan demikian, ketika kita bergerak ke kanan sumbu x, kita melihat bagaimana jumlah partikel yang teradsorpsi meningkat tergantung pada peningkatan tekanan atau konsentrasi mereka. Ini mengarah ke maksimum, pembusukan, lembah, dll., Entah bagaimana itu memungkinkan untuk menafsirkan bagaimana adsorpsi terjadi.
Isoterm tipe I
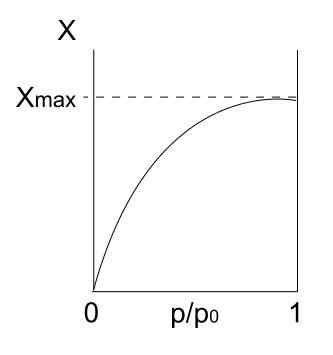 Isoterm tipe I. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0)
Isoterm tipe I. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0) Kami memiliki isoterm tipe I di atas, yang juga dikenal sebagai isoterm langmuir, karena modelnya memperkirakan bentuk kurva ini. Melihatnya, segera ditafsirkan bahwa ada jumlah maksimum (xmax) dari partikel yang teradsorpsi, yang tidak akan bervariasi tidak peduli berapa banyak tekanan meningkat.
Nilai adsorpsi maksimum ini mungkin disebabkan oleh beberapa alasan. Salah satunya adalah bahwa chemisortion sedang terjadi, yang berarti bahwa partikel atau adsorbat terikat kuat pada permukaan padatan atau adsorben. Setelah tidak ada lagi ruang di permukaan untuk mengakomodasi lebih banyak partikel, tidak akan ada lagi adsorpsi.
Kemudian dikatakan bahwa monolayer telah terbentuk (seperti lingkaran ungu dari gambar pertama).
Alasan lain untuk membenarkan isoterm tipe I adalah bahwa terjadi fisisorpsi, yang berarti bahwa interaksi permukaan partikel sangat lemah (mereka tidak menyiratkan pembentukan ikatan kimia).
Dalam hal ini, partikel akhirnya memasuki mikroporo, yang pernah diisi, permukaan tidak akan memiliki lebih banyak tempat untuk adsorctions berikut; Artinya, ia memiliki sedikit area eksternal yang tersedia (seolah -olah itu adalah kisi yang sangat halus). Perilaku ini diamati ketika bubuk mikro dianalisis.
Dapat melayani Anda: silikon: sejarah, sifat, struktur, mendapatkan, menggunakanKetik isoterm Ii
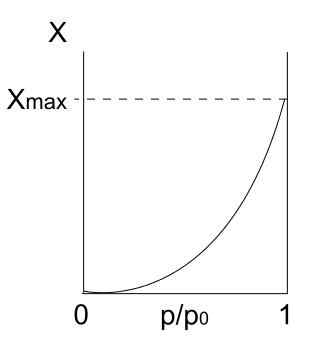
 Isoterm tipe II. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0)
Isoterm tipe II. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0) Up We Have Tipe II Isoterm, juga dikenal sebagai isoterm sigmoid. Ini menggambarkan proses physis untuk padatan yang tidak bermoral dan padatan makropor.
Perhatikan bahwa pada awalnya menyerupai isoterm sebelumnya, yang berarti bahwa partikel yang teradsorpsi membentuk monolayer pada permukaan adsorben. Setelah monolayer siap, partikel -partikel lain akan teradsorpsi di atas yang pertama, memunculkan multilayer. Inilah saat kita melihat peningkatan karakteristik isoterm ini (kanan).
Alasan lain mengapa isoterm tipe II diperoleh adalah karena partikel merasakan afinitas yang lebih besar terhadap permukaan daripada diri mereka sendiri. Yaitu, monolayer (partikel-superficie) akan lebih stabil dan bertahan daripada multilayer (partikel partikel) nanti.
Ketik isoterm AKU AKU AKU
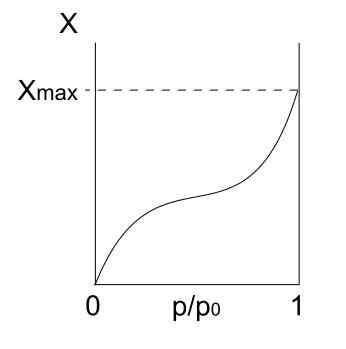
 Isoterm tipe III. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0)
Isoterm tipe III. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0) Isoterm tipe III mirip dengan tipe II dalam hal interpretasinya: multicapa dan physis. Namun, kali ini interaksi antara multicapa lebih kuat daripada monolayer dengan permukaan padatan. Oleh karena itu, ini adalah adsorpsi yang tidak teratur, dengan gundukan partikel yang teradsorpsi dan bagian permukaan bebas.
Ketik isoterm Iv
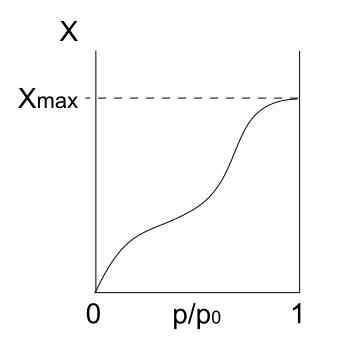 Isoterm tipe IV. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0)
Isoterm tipe IV. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0) Isoterm tipe IV juga menjelaskan proses fisisorpsi dan multilayer, terlihat seperti isoterm tipe II; Tapi sekarang, dalam padatan berpori (dan mesopori), di mana kondensasi partikel gas dimungkinkan dalam volume cairan kecil. Sampai pori dengan cairan "tertutup", monolayer tidak akan lengkap.
Dapat melayani Anda: Kimia Makanan: Bidang Studi, Elemen, AplikasiKetik isoterm V
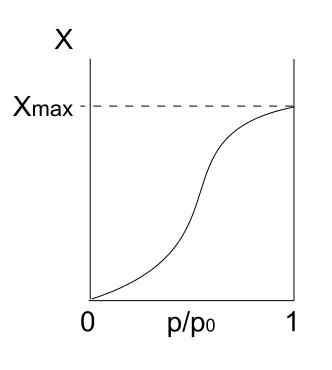 Isoterm tipe V. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0)
Isoterm tipe V. Sumber: Daniele Pugliesi/CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0) Isoterm tipe V mirip dengan tipe IV, hanya kali ini formasi multicapa lebih rentan daripada mono forpa masing -masing. Yaitu, menyerupai adsorpsi yang dijelaskan oleh isoterm tipe III. Di sini multicapa mencapai ketebalan maksimum, di mana tidak ada tempat untuk lebih banyak partikel untuk disesuaikan.
Contoh
Beberapa contoh sistem gas-solid akan disebutkan di bawah di sebelah jenis isoterm yang telah diperoleh dalam studi eksperimental mereka:
-Amonia-karbon (tipe I)
-Nitrogen-zeolit (tipe I)
-Hidrogen-karbon pada suhu tinggi (tipe I)
-Oxygen-Negro Batubara (Tipe I)
-Silika Nitrogen (Tipe II)
-Nitrogen-Hierro (Tipe II)
-Silica Bromo-Gel (Tipe III)
-Silica Iodine Vapor (Tipe III)
-Nitrogen-politik (tipe III)
-Kripton-Negro dari batubara (tipe IV)
-Benzene-gel oksida besi (tipe IV)
-Air uap-karbon (Tipe V)
Perhatikan bahwa padatan yang disebutkan adalah batubara, batu bara hitam, besi logam, besi oksida, zeolit dan gel silika. Semuanya adalah contoh adsorben yang baik dengan berbagai aplikasi industri.
Referensi
- Walter J. Moore. (1963). Kimia Fisik. Dalam termodinamika dan keseimbangan kimia. (Edisi keempat.). Longmans.
- Iran. Levine. (2009). Prinsip -prinsip fisikokimia. Edisi Keenam, Halaman 479-540. MC Graw Hill.
- Glasstone. (1970). Buku Teks Kimia Fisik. Edisi kedua. D. Van Nostrand, Company, Inc.
- Unit 3. Fenomena Permukaan. (S.F.). Adsorpsi. [PDF]. Pulih dari: depa.Fquim.Unam.MX
- Lowell S., Shields J.DAN. (1984) Isoterm Adsorpsi. Dalam: luas permukaan bubuk dan porositas. Springer, Dordrecht.
- Elsevier b.V. (2020). Isoterm adsorpsi. Ilmiah. Diperoleh dari: Scientedirect.com
- Wikipedia. (2020). Adsorpsi. Diperoleh dari: di.Wikipedia.org

