Struktur dan fungsi lactoferrin

- 2363
- 303
- Leland Robel
Itu Lactoferrin, Juga dikenal sebagai apolactoferrin atau lactotransferrin, ini adalah glikoprotein yang diproduksi oleh banyak spesies mamalia yang memiliki kemampuan untuk bergabung dan mentransfer ion besi (Fe3+). Ini dalam banyak cairan tubuh dan terkait dengan protein plasma pengikatan besi yang dikenal sebagai "transferin".
Itu diisolasi pada tahun 1939 oleh Sorensen dan Sorensen dari susu sapi dan, hampir 30 tahun kemudian, pada tahun 1960, Johannson menentukan kehadirannya dalam susu manusia (namanya berasal dari klasifikasinya sebagai protein serikat besi yang paling berlimpah dari susu besi yang paling berlimpah).
 Struktur Lactoferrin (Sumber: Liejealso [domain publik] melalui Wikimedia Commons)
Struktur Lactoferrin (Sumber: Liejealso [domain publik] melalui Wikimedia Commons) Investigasi selanjutnya mengidentifikasi laktoferin dalam sekresi kelenjar eksokrin lainnya seperti empedu, jus pankreas dan sekresi usus kecil, serta dalam butiran sekunder neutrofil, sel plasma milik sistem kekebalan.
Protein ini juga ditemukan dalam air mata, air liur, semen, cairan vagina, sekresi bronkial dan hidung dan urin, meskipun sangat berlimpah dalam susu (ini adalah protein kedua dalam konsentrasi yang lebih besar setelah kasein) dan kalsoster.
Meskipun pada awalnya dianggap hanya sebagai protein dengan aktivitas susu bakteriostatik, itu adalah protein dengan berbagai fungsi biologis, meskipun tidak semua ada hubungannya dengan kapasitas transfer ion besi mereka.
[TOC]
Struktur Lactoferrin
Lactoferrin, seperti yang disebutkan. Ini adalah protein dasar, dimuat secara positif dan dengan titik isoelektrik antara 8 dan 8.5.
Lobus dan lobus c
Ini dibentuk oleh rantai polipeptida tunggal yang dilipat untuk membentuk dua lobus simetris yang disebut lobus (1-332 limbah) dan lobus C (344-703 limbah yang berbagi antara 33 dan 41% homologi di antara mereka sendiri.
Dapat melayani Anda: lipoproteinBaik lobus dan lobus C dibentuk oleh lembaran β-lipit dan baling-baling alpha, yang merupakan dua domain dengan lobus, domain I dan domain II (C1, C2, N1 dan N2).
Kedua lobus terhubung melalui wilayah "engsel" yang terdiri dari baling -baling alfa antara limbah 333 dan 343, yang memberikan fleksibilitas molekuler yang lebih besar terhadap protein.
Analisis urutan asam amino dari protein ini mengungkapkan sejumlah besar situs potensial untuk glikosilasi. Tingkat glikosilasi sangat bervariasi dan menentukan resistensi terhadap aktivitas protease atau pH yang sangat rendah. Sakarida yang paling umum di bagian karbohidratnya adalah tangan, dengan lebih atau kurang 3% dari gula hexous dan 1% heksosamin.
Setiap lobulus lactoferrin mampu mengikat secara reversibel ke dua ion logam, apakah besi (Fe2+, Fe3+), tembaga (Cu2+), seng (Zn2+), kobalt (CO3+) atau mangan (MN2+), dalam sinergis dengan ionik bikargonat bikargonat (MN2+), dalam sinergis dengan ion bikargonat bikargonat bikargonat (Mn2+), dalam sinergis dengan bikargonat bikargonat bikargonat (MN2+), dalam sinergy bikargonat bikargonat bikargonat bikargonat.
Molekul lain
Ini juga dapat bergabung, meskipun dengan afinitas yang lebih sedikit, molekul lain seperti lipopolysaccharides, glikosaminoglikan, DNA dan heparin.
Ketika protein terkait dengan dua ion besi dikenal sebagai hollactoferrin, sedangkan ketika berada dalam bentuk "bebas", itu disebut apolctoferrin dan ketika hanya terkait dengan atom besi dikenal sebagai laktoferrin -farly tunggal.
Apolactoferrin memiliki konformasi terbuka, sementara itu hololactoferrin memiliki konfigurasi tertutup, jadi lebih tahan proteolisis resisten.
Bentuk Lactoferrin lainnya
Beberapa penulis menggambarkan keberadaan tiga isoform laktoferin: α, β dan γ. Bentuk lactoferrin-α dilambangkan dengan kemampuan untuk menyatu untuk menyetrika dan tanpa aktivitas ribonuclease. Lactoferrin -β dan Lactoferrin -γ bentuk memiliki aktivitas ribonuclease, tetapi mereka tidak dapat bergabung dengan ion logam.
Fungsi
Lactoferrin adalah glikoprotein dengan afinitas untuk penyatuan besi yang jauh lebih unggul daripada transferin, protein konveyor besi dalam plasma darah, yang memberikan kemampuan untuk bergabung dengan ion logam ini dalam berbagai pH pH yang luas.
Dapat melayani Anda: isolasi geografisMengingat fakta bahwa ia memiliki beban bersih yang positif dan didistribusikan dalam berbagai jaringan, itu adalah protein multifungsi yang terlibat dalam berbagai fungsi fisiologis seperti:
- Pengaturan penyerapan zat besi usus
- Proses respons imun
- Mekanisme antioksidan tubuh
- Itu bertindak sebagai agen antisinogenik dan anti -inflamasi
- Dia adalah agen pelindung terhadap infeksi mikroba
- Bekerja sebagai faktor transkripsi
- Terlibat dalam penghambatan protease
- Ini adalah protein antivirus, antijamur dan antiparasit
- Ini juga berfungsi sebagai prokoagulan dan memiliki aktivitas ribonuclease
- Itu adalah faktor pertumbuhan tulang.
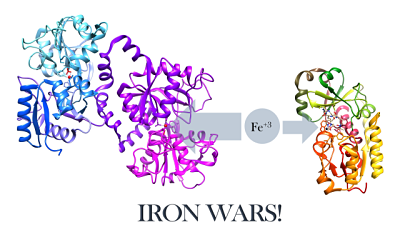 Representasi struktural lactoferrin dan siderofor E. Coli (sumber: w.Henley [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons)
Representasi struktural lactoferrin dan siderofor E. Coli (sumber: w.Henley [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons) Mengenai pertempuran infeksi mikroba, Lactoferrin bertindak dalam dua cara:
- Menculik zat besi di lokasi infeksi (yang menyebabkan kurangnya nutrisi dalam mikroorganisme menular, bertindak sebagai bakteriostatik) atau
- Berinteraksi langsung dengan agen infeksius, yang dapat menyebabkan lisis sel.
Penggunaan Farmakologis
Lactoferrin dapat diperoleh secara langsung ketika dimurnikan dari susu sapi, tetapi sistem modern lainnya didasarkan pada produksinya sebagai protein rekombinan dalam berbagai organisme yang mudah, cepat dan ekonomis pertumbuhan.
Sebagai senyawa aktif dari beberapa obat, protein ini digunakan untuk pengobatan lambung dan bisul usus, serta diare dan hepatitis C.
Ini digunakan untuk melawan infeksi bakteri dan virus dan, di samping itu, digunakan sebagai sistem kekebalan tubuh yang menstimulasi pencegahan beberapa patologi seperti kanker.
Sumber lactoferrin dalam tubuh manusia
Ekspresi protein ini pada awalnya dapat dideteksi pada tahap dua dan empat sel perkembangan embrionik dan kemudian pada tahap blastokista, sampai saat implementasi.
Dapat melayani Anda: evolusi mikroKemudian dibuktikan dalam neutrofil dan sel epitel sistem pencernaan dan reproduksi dalam pembentukan.
Sintesis protein ini dilakukan dalam epitel myeloid dan sekretori. Pada manusia dewasa, kadar ekspresi laktoferin tertinggi terdeteksi dalam ASI dan kalsoster.
Ini juga dapat ditemukan di banyak sekresi lendir seperti uterus, cairan seminal dan vagina, dalam air liur, empedu, jus pankreas, sekresi usus tipis, lubang hidung dan air mata. Telah ditentukan bahwa kadar perubahan protein ini selama kehamilan dan selama siklus menstruasi wanita.
Pada tahun 2000, produksi lactoferrin di ginjal ditentukan, di mana ia diekspresikan dan disekresikan melalui tubulus pengumpulan dan dapat diserap kembali di bagian distal dari mereka.
Kebanyakan laktoferin plasma pada manusia dewasa berasal dari neutrofil, di mana ia disimpan dalam butiran sekunder tertentu dan butiran tersier (meskipun dalam konsentrasi yang lebih rendah).
Referensi
- Adlerva, l., Bartoskova, a., & Faldyna, m. (2008). Lactoferrin: ulasan. Kedokteran Veterinarni, 53 (9), 457-468.
- Berlutti, f., Pantanella, f., Natalizi, t., Frioni, a., Paesano, r., Polimeni, a., & Valenti, P. (2011). Sifat antivirus laktoferrin-molekul kekebalan alami. Molekul, 16 (8), 6992-7018.
- Brock, J. (sembilan belas sembilan puluh lima). Lactoferrin: protein imunoregulasi multifungsi? Imunologi Today, 16 (9), 417-419.
- Brock, J. H. (2002). Fisiologi lactoferrin. Biokimia dan Biologi Sel, 80 (1), 1-6.
- González-Chavez, s. KE., Arévalo-Gallegos, s., & Rascón-cruz, q. (2009). Lactoferrin: Struktur, Fungsi dan Aplikasi. Jurnal Internasional Agen Antimikroba, 33 (4), 301-E1.
- Alicay, hlm. F., & Viljoen, m. (sembilan belas sembilan puluh lima). Lactoferrin: Tinjauan Umum. Haematologica, 80 (3), 252-267.
- Naot, d., Abu -abu, a., Reid, i. R., & Cornish, J. (2005). Lactoferrin-faktor pertumbuhan tulang baru. Kedokteran & Penelitian Klinis, 3 (2), 93-101.
- Sanchez, l., Calvo, m., & Brock, J. H. (1992). Peran biologis lactoferrin. Archives of Disease in Childhood, 67 (5), 657.
- « Karakteristik replikasi virus, siklus replikasi virus, contoh (HIV)
- Struktur etidium bromida, sifat, penggunaan, toksisitas »

