Hukum Beer-Lambert
- 5015
- 241
- Irvin Reichel
Apa itu Hukum Beer-Lambe?
Itu Hukum Beer-Lambert (Bouguer bir) adalah salah satu yang menghubungkan penyerapan radiasi elektromagnetik dari satu atau lebih spesies kimia, dengan konsentrasi dan jarak yang mengalir cahaya dalam interaksi partikel-foton. Undang -undang ini menyatukan dua undang -undang dalam satu.
Hukum Bouguer (meskipun pengakuan telah jatuh lebih banyak tentang Heinrich Lambert), menetapkan bahwa sampel akan menyerap radiasi yang lebih besar ketika dimensi lingkungan penyerap atau material lebih besar; khususnya, ketebalannya, yang menjadi jarak l Itu mengalir melalui cahaya saat masuk dan keluar.
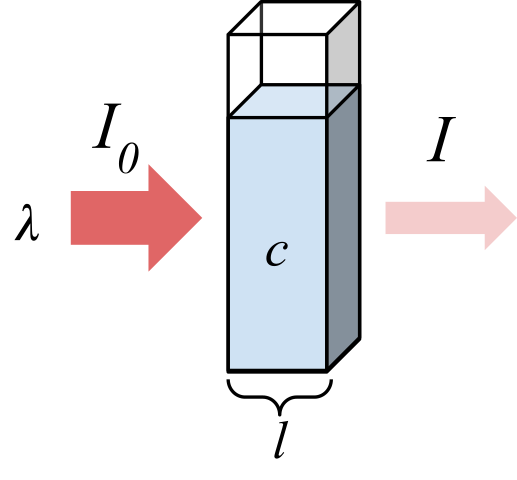 Radiasi diserap oleh sampel. Sumber: marmot2019 [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)], dari Wikimedia Commons
Radiasi diserap oleh sampel. Sumber: marmot2019 [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)], dari Wikimedia Commons Gambar superior menunjukkan penyerapan radiasi monokromatik; yaitu, terdiri dari panjang gelombang tunggal, λ. Media penyerap ada di dalam sel optik, yang ketebalannya l, dan mengandung spesies kimia dengan konsentrasi C.
Balok cahaya memiliki intensitas awal dan akhir, ditunjuk dengan simbol i0 dan saya masing -masing. Perhatikan bahwa setelah berinteraksi dengan media penyerap, saya kurang dari saya0, yang menunjukkan bahwa ada penyerapan radiasi. Semakin tua mereka C Dan l, lebih kecil adalah saya sehubungan dengan i0; Artinya, akan ada lebih banyak penyerapan dan lebih sedikit transmitansi.
Penjelasan Hukum Beer-Lambe
Gambar superior dengan sempurna mencakup hukum ini. Penyerapan radiasi dalam sampel meningkat atau berkurang secara eksponensial tergantung pada C salah satu l. Untuk membiarkan hukum sepenuhnya dan mudah dipahami, perlu untuk membatasi aspek matematikanya.
Seperti yang baru saja disebutkan, saya0 Dan saya adalah intensitas sinar cahaya monokromatik sebelum dan sesudah cahaya, masing -masing. Beberapa teks lebih suka menggunakan simbol p0 dan p, yang menyinggung energi radiasi dan tidak dengan intensitasnya. Di sini, penjelasan akan terus menggunakan intensitas.
Dapat melayani Anda: acetophenoneUntuk linearisasi persamaan hukum ini, logaritma harus diterapkan, biasanya basis 10:
Log (i0/I) = εlC
Istilah (i0/I) menunjukkan seberapa besar intensitas produk radiasi dari penyerapan berkurang. Hukum Lambert hanya mempertimbangkan l (εl), sementara bir mengabaikan l, tapi tempat -tempat C Sebagai gantinya (εC). Persamaan yang lebih tinggi adalah penyatuan kedua undang-undang, dan oleh karena itu adalah ekspresi matematika umum untuk hukum bir-lambe.
Absorbansi dan transmitansi
Absorbansi ditentukan oleh istilah log (i0/YO). Dengan demikian, persamaan dinyatakan sebagai berikut:
A = εlC
Di mana ε adalah koefisien kepunahan atau absorganitas molar, yang merupakan konstanta pada panjang gelombang tertentu.
Perhatikan bahwa jika ketebalan penyerap tetap konstan, seperti ε, absorbansi hanya bergantung pada konsentrasi C, spesies penyerap. Selain itu, ini adalah persamaan linier, y = mx, di mana Dan adalah A, dan X adalah C.
Dengan meningkatnya absorbansi, transmitansi berkurang; Ini adalah, berapa banyak radiasi yang dikelola untuk ditransmisikan setelah penyerapan. Karena itu mereka terbalik. Ya0/I menunjukkan tingkat penyerapan, I/I0 Itu sama dengan transmitansi. Mengetahui hal ini:
I/i0 = T
(YO0/I) = 1/t
Log (i0/I) = log (1/t)
Tapi, log (i0/I) Ini juga sama dengan absorbansi. Jadi hubungan antara dan T adalah:
A = log (1/t)
Dan menerapkan sifat -sifat logaritma dan mengetahui bahwa log1 sama dengan 0:
A = -logt
Biasanya transmisi dinyatakan dalam persentase:
%T = i/i0∙ 100
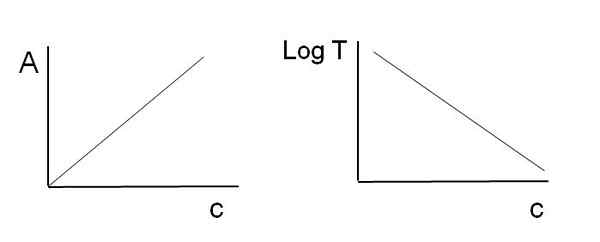
Grafik
Seperti yang dinyatakan di atas, persamaan sesuai dengan fungsi linier; Oleh karena itu, diharapkan bahwa saat memberi grafik kepada mereka, mereka akan memberikan garis.
Dapat melayani Anda: apa itu kinetika kimia? Grafik yang digunakan untuk hukum bir-lambert. Sumber: Gabriel Bolívar
Grafik yang digunakan untuk hukum bir-lambert. Sumber: Gabriel Bolívar Perhatikan bahwa di sebelah kiri gambar di atas Anda memiliki garis yang diperoleh saat grafik melawan C, dan di sebelah kanan garis yang sesuai dengan grafik logt terhadap C. Satu memiliki kemiringan positif, dan yang lainnya negatif; Semakin besar absorbansi, semakin rendah transmitansi.
Berkat linearitas ini, konsentrasi spesies kimia penyerap (kromofor) dapat ditentukan jika diketahui berapa banyak radiasi yang mereka serap (a), atau berapa banyak radiasi yang ditransmisikan (logt). Ketika linearitas ini tidak diamati, dikatakan bahwa ia menghadapi penyimpangan, positif atau negatif, dari hukum bir-lambert.
Aplikasi Hukum Beer-Lambe
Secara umum, beberapa aplikasi terpenting dari undang -undang ini disebutkan di bawah ini:
-Jika spesies kimia memiliki warna, itu adalah kandidat yang patut dicontoh untuk dianalisis dengan teknik kolorimetri. Ini didasarkan pada hukum bir-lambert, dan memungkinkan untuk menentukan konsentrasi analit berdasarkan absorbansi yang diperoleh dengan spektrofotometer.
-Ini memungkinkan untuk membangun kurva kalibrasi, yang dengan mempertimbangkan efek matriks sampel, konsentrasi spesies yang menarik ditentukan.
-Ini banyak digunakan untuk menganalisis protein, karena beberapa asam amino memiliki penyerapan penting di daerah ultraviolet dari spektrum elektromagnetik.
-Reaksi kimia atau fenomena molekuler yang menyiratkan perubahan pewarnaan, dapat dianalisis dengan nilai absorbansi, pada satu atau lebih panjang gelombang.
-Membuat analisis multivariat, campuran kromofor kompleks dapat dianalisis. Dengan cara ini, konsentrasi semua analit dapat ditentukan, dan juga, mengklasifikasikan campuran dan membedakannya satu sama lain; Misalnya, mengesampingkan jika dua mineral identik berasal dari benua atau negara spesifik yang sama.
Dapat melayani Anda: asam kuatLatihan terpecahkan
Latihan 1
Apa absorbansi larutan yang menyajikan transmitansi 30% ke panjang gelombang 640 nm?
Untuk menyelesaikannya, cukup pergi ke definisi absorbansi dan transmitansi.
%T = 30
T = (30/100) = 0.3
Dan mengetahui bahwa a = -logt, perhitungannya langsung:
A = -log 0,3 = 0,5228
Perhatikan bahwa Anda tidak memiliki unit.
Latihan 2
Jika pembubaran tahun sebelumnya terdiri dari spesies W yang konsentrasinya 2,30 ∙ 10-4 M, dan dengan asumsi bahwa sel memiliki ketebalan 2 cm: apa yang seharusnya menjadi konsentrasinya untuk mendapatkan transmitansi 8%?
Itu bisa diselesaikan secara langsung dengan persamaan ini:
-Logt = εlC
Tapi, nilai ε tidak diketahui. Oleh karena itu, harus dihitung dengan data sebelumnya, dan diasumsikan bahwa itu tetap konstan dalam berbagai konsentrasi:
ε = -logt/lC
= (-Log 0.3)/ (2 cm x 2.3 ∙ 10-4 M)
= 1136.52 m-1∙ cm-1
Dan sekarang, Anda dapat melanjutkan untuk menghitung dengan %t = 8:
C = -Logt/εl
= (-Log 0,08)/ (1136,52 m-1∙ cm-1 x 2cm)
= 4.82 ∙ 10-4 M
Kemudian, cukup bahwa spesies W menggandakan konsentrasinya (4,82/2.3) untuk mengurangi persentase transmitansi 30% menjadi 8%.
Referensi
- Hukum Beer-Lambert. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Hukum Beer-Lambert. Pulih dari: chemguide.bersama.Inggris
- « Darwinisme sosial apa itu, karakteristik, penulis, konsekuensi
- Konsekuensi badai dan badai di ekosistem »

