Rumus dan unit Hukum Charles, Eksperimen, Latihan

- 2915
- 87
- Jessie Harvey
Itu Hukum Charles atau dari Guy-Lussac adalah salah satu yang memungkinkan pernyataan salah satu sifat dari keadaan gas: volume yang ditempati gas secara langsung sebanding dengan suhu pada tekanan konstan.
Proporsionalitas ini linier untuk semua rentang suhu jika gas yang dimaksud ideal; Gas kerajaan, di sisi lain, menyimpang dari tren linier pada suhu yang dekat dengan titik kondensasi mereka. Namun, ini tidak membatasi penggunaan undang -undang ini untuk aplikasi tanpa akhir di mana gas berpartisipasi.
 Lentera atau keinginan Cina. Sumber: Pxhere.
Lentera atau keinginan Cina. Sumber: Pxhere. Salah satu par Excellence of Charles's Law adalah kehadiran di balon aerodinamis. Balon lain yang lebih sederhana, seperti keinginan, juga disebut lampu Cina.
Mengapa Tekanan Konstan? Karena jika tekanan meningkat, itu berarti bahwa wadah tempat gas berada ditutup rapat; Dan dengan ini, tabrakan atau dampak partikel gas terhadap dinding internal wadah tersebut (Hukum Boyle-Maleotte) akan meningkatkan tabrakan atau dampak partikel internal (Hukum Boyle-Maleotte).
Oleh karena itu, tidak akan ada perubahan dalam volume yang ditempati oleh gas, dan hukum Charles tidak akan keras. Berlawanan dengan wadah hermetis, jaringan balon keinginan mewakili penghalang seluler, mampu memperluas atau berkontraksi tergantung pada tekanan yang diberikan oleh gas di dalam.
Namun, ketika jaringan balon mengembang, tekanan internal gas tetap konstan karena meningkatkan area di mana partikel -partikelnya bertabrakan. Semakin tinggi suhu gas, semakin besar energi kinetik partikel, dan oleh karena itu, jumlah tabrakan.
Dan ketika dunia mengembang lagi, tabrakan terhadap dinding internalnya tetap konstan (idealnya).
Jadi, semakin panas gasnya, semakin besar perluasan dunia dan semakin banyak akan naik. Hasilnya: lampu kemerahan (meskipun berbahaya) tergantung di langit selama malam Desember.
[TOC]
Apa Hukum Charles?
Penyataan
Hukum Charles yang disebut atau hukum gay-Lussac menjelaskan ketergantungan yang ada antara volume yang ditempati oleh gas dan nilai suhu absolut atau suhu kelvinnya.
Hukum dapat diucapkan sebagai berikut: Jika tekanan tetap konstan, dipenuhi bahwa “untuk massa gas tertentu, ia meningkatkan volumenya sebesar 1/273 kali kira -kira volumenya menjadi 0 ºC, untuk setiap derajat Celcius (1 ºC ) yang meningkatkan suhunya ".
Pekerjaan
Pekerjaan penelitian yang memungkinkan pembentukan undang-undang dimulai pada 1780-an oleh Jacques Alexander Cesar Charles (1746-1823). Namun, Charles tidak mempublikasikan hasil penyelidikannya.
Selanjutnya, John Dalton pada tahun 1801 berhasil secara eksperimental menentukan bahwa semua gas dan uap, dipelajari olehnya, berkembang di antara dua suhu yang ditentukan dalam volume yang sama. Hasil ini dikonfirmasi oleh Gay-Lussac pada tahun 1802.
Karya Penelitian Charles, Dalton dan Gay-Lussac, diizinkan untuk menetapkan bahwa volume yang ditempati oleh gas dan suhu absolutnya sebanding langsung. Oleh karena itu, ada hubungan linier antara suhu dan volume gas.
Itu dapat melayani Anda: metode pemisahan campuran heterogenGrafik
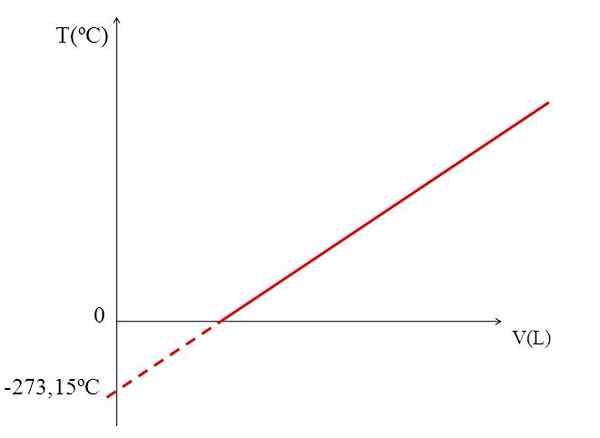 T VS V Grafik untuk Gas Ideal. Sumber: Gabriel Bolívar.
T VS V Grafik untuk Gas Ideal. Sumber: Gabriel Bolívar. Realisasi grafik (gambar atas) dari volume gas terhadap suhu menghasilkan garis lurus. Persimpangan garis dengan sumbu x, pada suhu 0 ºC, memungkinkan untuk mendapatkan volume gas pada 0 ºC.
Demikian juga, persimpangan garis dengan sumbu X, akan memberikan informasi tentang suhu yang volume yang ditempati gas akan menjadi nol "0". Dalton memperkirakan nilai ini pada -266 ºC, dekat dengan nilai yang disarankan oleh Kelvin untuk absolut (0) Absolute.
Kelvin mengusulkan skala suhu yang nolnya harus menjadi suhu di mana gas sempurna akan memiliki volume nol. Tetapi pada suhu rendah ini gas dicairkan.
Itulah sebabnya kita tidak dapat berbicara tentang volume gas seperti itu, menemukan bahwa nilai untuk nol absolut harus -273,15 ºC.
Rumus dan unit pengukuran
Rumus
Hukum Charles dalam versi modernnya menunjukkan bahwa volume dan suhu gas secara langsung proporsional.
Jadi:
V / t = k
V = volume gas. T = suhu Kelvin (k). K = proporsionalitas konstan.
Untuk volume V1 dan suhu t1
k = v1 / T1
Juga, untuk volume v2 dan suhu t2
k = v2 / T2
Kemudian, mencocokkan dua persamaan untuk k yang Anda miliki
V1 / T1 = V2 / T2
Formula ini dapat ditulis sebagai berikut:
V1 · T2 = V2 · T1
Kliring v2, Formulanya diperoleh:
V2 = V1 · T2 / T1
Unit
Volume gas dapat diekspresikan dalam liter atau di salah satu unit yang diturunkan. Demikian juga, volume dapat dinyatakan dalam meter kubik atau di unit turunan mana pun. Suhu harus dinyatakan dalam suhu absolut atau suhu kelvin.
Jadi, jika suhu gas dinyatakan dalam skala Celcius atau Celcius, untuk melakukan perhitungan dengan mereka, jumlah 273,15 ºC harus ditambahkan ke suhu, untuk membawa mereka ke suhu absolut atau kelvin.
Jika suhu diekspresikan dalam derajat Farenheit, itu harus ditambahkan ke suhu tersebut 459,67 ºR, untuk membawa mereka ke suhu absolut pada skala Rankine.
Formula hukum Charles lainnya yang diketahui, dan secara langsung terkait dengan pernyataannya, adalah sebagai berikut:
VT = Vsalah satu (1 + t/273)
Dimana vT Itu adalah volume yang ditempati oleh gas pada suhu tertentu, dinyatakan dalam liter, cm3, dll.; dan vsalah satu Itu adalah volume yang ditempati oleh gas pada 0 ºC. Untuk bagiannya, T adalah suhu di mana pengukuran volume dilakukan, dinyatakan dalam derajat Celcius (ºC) (ºC).
Dan akhirnya, 273 mewakili nilai nol absolut pada skala suhu Kelvin.
Bereksperimen untuk menunjukkan hukum
Pemasangan
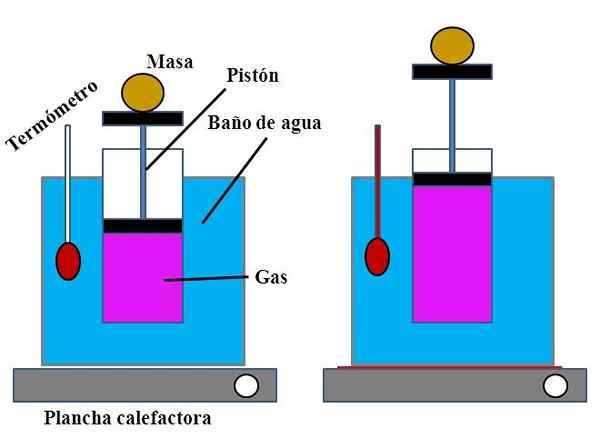 Majelis Percobaan untuk Menunjukkan Hukum Charles. Sumber: Gabriel Bolívar.
Majelis Percobaan untuk Menunjukkan Hukum Charles. Sumber: Gabriel Bolívar. Dalam wadah air, yang memenuhi fungsi penangas air, silinder terbuka ditempatkan di bagian atasnya, dengan plunger yang disesuaikan dengan dinding bagian dalam silinder (gambar superior).
Plunger ini (dibentuk oleh piston dan dua pangkalan hitam) dapat bergerak ke bagian atas atau bawah silinder tergantung pada volume gas yang terkandung.
Bath air dapat dipanaskan dengan menggunakan pabrik pemanas atau pemanas, yang memasok panas yang diperlukan untuk meningkatkan suhu kamar mandi dan oleh karena itu, suhu silinder yang dilengkapi dengan plunger.
Dapat melayani Anda: kalsium hidroksida (ca (oh) 2): struktur, sifat, mendapatkan, menggunakanPada plunger, massa tertentu ditempatkan untuk memastikan bahwa percobaan dilakukan pada tekanan konstan. Kamar mandi dan suhu silinder diukur dengan menggunakan termometer yang ditempatkan di penangas air.
Meskipun mungkin silinder tidak memiliki kelulusan untuk memvisualisasikan volume udara, ini dapat diperkirakan dengan mengukur ketinggian massa yang ditempatkan pada plunger dan permukaan dasar silinder.
Perkembangan
Volume silinder diperoleh dengan mengalikan permukaan alasnya dengan tinggi badannya. Permukaan dasar silinder dapat diperoleh dengan menerapkan rumus: s = pi x r2.
Sedangkan tinggi diperoleh dengan mengukur jarak dari pangkal silinder, ke piston di mana adonan bertumpu.
Ketika suhu kamar mandi meningkat dengan panas yang diproduksi oleh yang lebih ringan, diamati bahwa plunger naik di dalam silinder. Kemudian, mereka membaca suhu dalam penangas air di termometer, yang sesuai dengan interior silinder.
Mereka juga mengukur ketinggian adonan pada plunger, mampu memperkirakan volume udara yang sesuai dengan suhu yang diukur. Dengan cara ini mereka melakukan beberapa pengukuran suhu dan perkiraan volume udara yang sesuai dengan masing -masing suhu.
Ini akhirnya dapat menetapkan bahwa volume yang ditempati oleh gas berbanding lurus dengan suhunya. Kesimpulan ini memungkinkan untuk menyatakan hukum Charles yang disebut SO.
Globo dengan es di musim dingin
Selain percobaan sebelumnya, ada yang lebih sederhana dan lebih kualitatif: bahwa balon dengan es di musim dingin.
Jika di musim dingin sebuah balon penuh helium di sebuah ruangan dengan pemanasan ditempatkan, dunia akan memiliki volume tertentu; Tapi, jika kemudian dipindahkan ke bagian luar rumah dengan suhu rendah, akan diamati bahwa balon helium menyusut, mengurangi volumenya menurut hukum Charles.
Latihan terpecahkan
Latihan 1
Anda memiliki gas yang menempati volume 750 cm3 Pada 25 ºC: apa yang akan menjadi volume yang ditempati gas ini pada 37 ºC jika tekanan konstan dipertahankan?
Pertama -tama perlu mengubah unit suhu menjadi Kelvin:
T1 Dalam derajat kelvin = 25 ºC + 273.15 ºC = 298.15 K
T2 Dalam derajat kelvin = 37 ºC + 273.15 ºC = 310.15 K
Karena diketahui v1 dan variabel lainnya, itu membersihkan v2 Dan dihitung dengan persamaan berikut:
V2 = V1 · (T2 / T1)
= 750 cm3 · (310.15 K / 298.15 K)
= 780.86 cm3
Latihan 2
Apa yang akan menjadi suhu dalam derajat Celcius yang 3 liter gas harus dipanaskan hingga 32 ° C, sehingga volumenya meluas hingga 3,2 liter?
Sekali lagi, gelar Celcius di Kelvin diubah:
T1 = 32 ºC + 273.15 ºC = 305.15 K
Dan seperti dalam latihan sebelumnya, T dibersihkan2 Bukannya v2, dan kemudian menghitung:
T2 = V2 · (T1 / V1)
= 3.2 L · (305.15 K / 3 L)
= 325.49 k
Tapi pernyataan itu meminta derajat Celcius, jadi unit T berubah2:
T2 Dalam derajat Celcius = 325, 49 º C (k) - 273.15 ºC (k)
Dapat melayani Anda: jarum suntik pascal= 52.34 ºC
Latihan 3
Jika gas pada 0 ºC menempati volume 50 cm3, Volume apa yang akan ditempati pada 45 ºC?
Menggunakan formula asli Hukum Charles:
VT = Vsalah satu (1 + t /273)
Lanjutkan untuk menghitung vT Langsung saat Anda membuang semua variabel:
VT = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (k))
= 58.24 cm3
Di sisi lain, jika masalah diselesaikan dengan menggunakan strategi Contoh 1 dan 2, kita akan memiliki:
V2 = V1 · (T2 / T1)
= 318 K · (50 cm3 / 273 k)
= 58.24 cm3
Hasilnya, menerapkan kedua prosedur, adalah sama karena pada akhirnya didasarkan pada prinsip hukum Charles yang sama.
Aplikasi
Wishe Galls
Balon keinginan (sudah disebutkan dalam pendahuluan) dilengkapi dengan bahan tekstil yang diresapi dengan cairan yang mudah terbakar.
Saat kebakaran menembakkan bahan ini, ada peningkatan suhu udara yang terkandung di dunia, yang menyebabkan peningkatan volume gas menurut hukum Charles.
Oleh karena itu, dengan meningkatkan volume udara di dunia, kepadatan udara berkurang di dalamnya, yang dibuat kurang dari kepadatan udara di sekitarnya, dan itulah sebabnya dunia naik.
Termometer atau kalkun pop-up
Seperti yang ditunjukkan oleh namanya, mereka digunakan selama memasak kalkun. Termometer memiliki wadah penuh udara tertutup dengan tutupnya dan dikalibrasi sedemikian rupa sehingga saat mencapai suhu memasak yang optimal, tutupnya diangkat dengan memancarkan suara.
Termometer ditempatkan di dalam kalkun, dan seiring dengan meningkatnya suhu di dalam oven, udara di dalam termometer mengembang, meningkatkan volume. Jadi ketika volume udara mencapai nilai tertentu, itu membuat lift lift termometer.
Pemulihan bentuk bola ping-pong
Bola ping-pong tergantung pada persyaratan penggunaannya, beratnya ringan dan dinding plastiknya sedikit tebal. Ini membuat mereka dipengaruhi oleh raket menderita deformasi.
Dengan menempatkan bola cacat dalam air panas, udara di dalamnya dipanaskan dan perluasannya terjadi, yang mengarah pada peningkatan volume udara. Ini juga menyebabkan hamparan dinding bola ping-pong, yang memungkinkan pemulihan bentuk aslinya.
Elaborasi paes
Ragi dimasukkan ke dalam tepung gandum yang digunakan untuk membuat roti dan memiliki kemampuan untuk menghasilkan gas karbon dioksida.
Dengan meningkatkan suhu roti selama memasak, volume karbon dioksida meningkat. Karena inilah perluasan roti terjadi sampai volume yang diinginkan tercapai.
Referensi
- Clark J. (2013). Hukum Gas Oter - Hukum Boyle dan Hukum Charles. Pulih dari: chemguide.bersama.Inggris
- Staroscik Andrew. (2018). Hukum Charles. Diperoleh dari: ScientEprimer.com
- Wikipedia. (2019). Hukum Charles. Diperoleh dari: di.Wikipedia.org
- Helmestine, Todd. (27 Desember 2018). Apa formula hukum Charles? Pulih dari: thinkco.com
- Prof. N. Dari singa. (S.F.). Hukum Gas Dasar: Hukum Charles. C 101 Catatan Kelas. Pulih dari: iun.Edu
- Briceño Gabriela. (2018). Hukum Charles. Pulih dari: euston96.com
- Morris, J. G. (1974). Fisikokimia untuk ahli biologi. (2memberi edisi). Editorial reverté, s.KE.
- « Empat belas poin latar belakang Wilson dan bagaimana hal itu mempengaruhi Jerman
- Aplikasi Konsep Energi, Kekuatan, Kekuatan, Pekerjaan »

