Hukum penjelasan, aplikasi, contoh
- 3452
- 306
- Mr. Darrell Streich
Itu Hess Law Ini adalah manifestasi lain dari hukum konservasi energi yang memungkinkan untuk menentukan, melalui jumlah aljabar sederhana, entalpi reaksi kimia. Dipahami dengan entalpi sebagai panas yang dilepaskan atau diserap, pada tekanan konstan, yang terkait dengan reaksi kimia atau fenomena kimia apa pun.
Enthalpies, ΔH, ditentukan secara eksperimental menggunakan kalorimetri. Namun, ada reaksi yang sulit dipelajari dengan teknik ini. Ketika ini terjadi, reaksi lain digunakan yang dimiliki entalpi spesifik mereka, dan yang memiliki minat atau senyawa yang menarik minat.
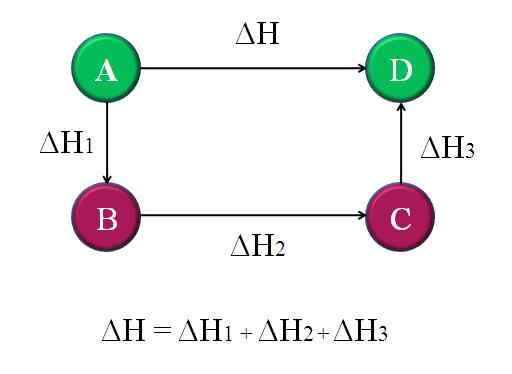
 Diagram Sederhana dan Umum Di mana Hukum Hess untuk Empat Reaksi Kimia diterapkan. Sumber: Gabriel Bolívar.
Diagram Sederhana dan Umum Di mana Hukum Hess untuk Empat Reaksi Kimia diterapkan. Sumber: Gabriel Bolívar. Dengan cara ini, "tidak diketahui" dari reaksi dapat dihitung. Misalnya, diagram teratas membantu memahami ide ini. Ada empat reaksi: A-D, A-B, B-C dan C-D. Reaksi A-D adalah yang memiliki ΔH terbesar, karena di mana mereka terjadi, sehingga untuk berbicara, perubahan kimia yang paling terkenal.
Reaksi lain, sedangkan, memiliki ΔH yang lebih kecil, karena mereka terdiri dari langkah -langkah alternatif atau reaksi alternatif untuk mencapai produk yang sama d. Oleh karena itu, jumlah ΔH1, ΔH2 dan ΔH3, Itu akan sama dengan ΔH. Mengetahui hal ini, ΔH, atau entalpi lainnya, dapat dihitung dengan menerapkan pembukaan sederhana. Ini adalah Hukum Hess.
Hukum Hess sangat berguna saat menghitung entalpi reaksi, serta melatih entalpi untuk senyawa yang berbeda atau perantara yang tidak stabil.
[TOC]
Penjelasan Hukum Hess
Perhitungan entalpi suatu reaksi
Alasan mengapa dipenuhi itu:
ΔH = ΔH1 + ΔH2 + ΔH3
Itu karena entalpi, atau perubahan entalpi, adalah fungsi negara. Ini berarti bahwa nilainya tidak dimodifikasi dengan jumlah langkah, tahapan atau reaksi perantara. Misalnya, ΔH akan tetap sama bahkan ketika ada ΔH10 yang harus dipertimbangkan dalam jumlah aljabar.
Entalpi dapat divisualisasikan sebagai puncak dari beberapa gunung. Tidak peduli bagaimana langkah -langkah menuju mereka diarahkan, ketinggian yang memisahkan mereka dari level MAR tidak akan pernah bervariasi. Dan justru ketinggian yang ditambahkan atau dikurangi untuk menentukan ketinggian yang tidak diketahui dari gunung di sekitarnya.
Kembali ke diagram sebelumnya: A, itu adalah gunung, dari gunung lain, dan sebagainya. Perbedaan tinggi antara A dan D atasan, adalah yang terbesar. Menambahkan ketinggian antara A-B, B-C dan C-D, itu akan memberikan tinggi A-D. Inilah yang dilakukan dengan entalpi reaksi kimianya masing -masing.
Dapat melayani Anda: kelompok fosfatEntalpi reaksi dari entalpi formasi
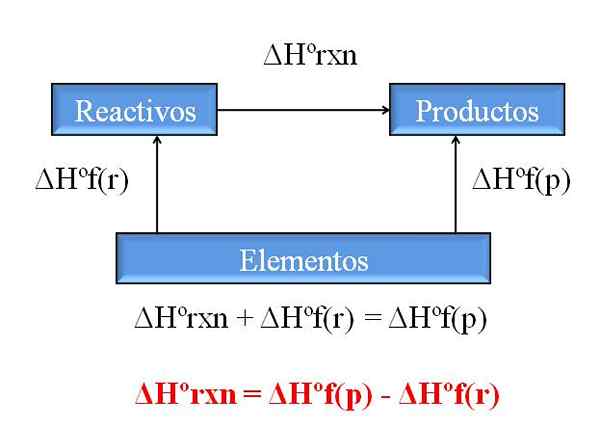 Diagram Umum Untuk Menghitung Entralpi Reaksi dari Entalpi Formasi. Sumber: Gabriel Bolívar.
Diagram Umum Untuk Menghitung Entralpi Reaksi dari Entalpi Formasi. Sumber: Gabriel Bolívar. Salah satu konsekuensi paling berharga dari hukum Hess adalah bahwa hal itu memungkinkan penentuan entalpi dari setiap reaksi kimia, mengambil entalpi pelatihan dari semua senyawa (reagen dan produk) yang terlibat.
Gambar superior menggambarkan hal ini. Dipahami dengan entalpi pembentukan panas yang terkait ketika senyawa terbentuk dari unsur -unsurnya. Entalpi ini akan menjadi perbedaan maksimum yang mungkin antara reagen dan produk, tanpa perlu berkonsultasi dengan reaksi kimia lainnya; Setidaknya, di luar pelatihan senyawa yang terpisah.
Bagaimana Anda membaca diagram kali ini? Trik adalah selalu menambahkan entalpi saat menuju ke arah panah, dan kurangi saat panah berada di rute yang berlawanan. Dengan demikian, ΔHºRXN, entalpi reaksi standar, menambah ΔHºF (reagen), entalpi standar pembentukan reagen, dan mereka dikurangi ΔHºF (produk), entalpi standar pembentukan produk dari produk.
Jumlah reaksi
Diagram bisa menjadi sangat rumit untuk ditafsirkan, terutama ketika ada banyak reaksi yang harus dipertimbangkan. Oleh karena itu, jumlah reaksi digunakan. Metode ini sangat memfasilitasi perhitungan entalpi, dan mempercepat pemahaman hukum Hess.
Misalkan Anda ingin menentukan ΔHºRXN dari reaksi berikut:
A + B + C → ABC
Dan kami juga memiliki dua reaksi lain:
A + B → AB (ΔHº1)
AB + C → ABC (ΔHº2)
Sangat menarik bahwa A + B + C berada di sisi kiri (reagen) dan bahwa ABC ada di sisi kanan (produk). Kemudian, kami cukup melanjutkan untuk menambahkan dua reaksi terakhir:
A + B → AB
AB + C → ABC
A + AB + C → ABC + AB
Karena AB dari kedua sisi dihilangkan. Jadi kami punya:
A + B + C → ABC
ΔHºRXN = ΔHº1 + ΔHº2
Menambahkan reaksi, penggunaan diagram apa pun dihilangkan.
Aplikasi hukum Hess
Hukum Hess mengizinkan, tanpa perlu percobaan, entalpi untuk reaksi atau fenomena kimia yang berbeda. Beberapa dari mereka terdaftar:
- Melatih entalpi untuk senyawa atau perantara yang tidak stabil, seperti yang biasanya kita miliki dalam kimia organik.
-Entalpi transisi fase, dalam studi padatan kristal.
Dapat melayani Anda: senyawa kimia-Entalpi transisi alotropik, seperti yang ada di antara grafit dan berlian.
Demikian juga, hukum Hess digunakan untuk menentukan energi reticular dari padatan, dan afinitas elektronik dari beberapa atom.
Contoh: latihan terpecahkan
- Contoh 1
Hitung ΔHRXN dari reaksi berikut:
2hcl (g) + f2(g) → 2hf (l) + cl2(G)
Jika Anda memiliki reaksi berikut dan entalpi masing -masing:
4hcl (g) + atau2(g) → 2h2Atau (l) + 2cl2(g) (ΔH = -202.4 kJ/mol)
1/2h2(g) + 1/2f2(g) → hf (l) (ΔH = -600.0 kJ/mol)
H2(g) + 1/2o2(g) → H2Atau (l) (ΔH = -285.8 kJ/mol)
Persamaan Pemesanan
Untuk memulai, kita harus menambahkan reaksi sedemikian rupa sehingga hcl dan f2 berada di sisi kiri, dan HF dan CL2, Di sisi kanan. Tetapi yang lebih penting, itu memperhatikan bahwa begitu banyak h2 abu2Atau tidak dalam persamaan bunga. Oleh karena itu, kita harus membatalkannya dalam jumlahnya, dan membuat koefisien stoikiometrik bertepatan dengan perkalian:
2hcl (g) + 1/22(g) → H2Atau (l) + cl2(g) (ΔH = -202.4 kJ/mol) * (1/2)
Persamaan ini dikalikan dengan 1/2 untuk memiliki 2hcl, bukan 4HCL
H2(g) + f2(g) → 2hf (l) (ΔH = -600.0 kJ/mol) * (2)
Persamaan ini dikalikan dengan 2 untuk memiliki f2 dan No 1/2F2
H2Atau (l) → h2(g) + 1/2o2(g) (ΔH = -285.8 kJ/mol) * (-1)
Sementara itu, yang terakhir dikalikan dengan -1 untuk "mengubahnya". Dengan demikian, kami memiliki persamaan yang dipesan dan siap ditambahkan.
Jumlah persamaan
Menambahkan semuanya memberi kita:
2hcl (g) + 1/22(g) → H2Atau (l) + cl2(g) (ΔH = -101.2 kJ/mol)
H2(g) + f2(g) → 2hf (l) ΔH = -1200.0 kJ/mol)
H2Atau (l) → h2(g) + 1/2o2(g) (ΔH = 285.8 kJ/mol)
2hcl (g) + f2(g) → 2hf (l) +cl2(G)
Perhatikan bahwa istilah 1/22, H2Atau dan h2 Mereka dibatalkan karena mereka berada di kedua sisi panah. Enthalpies juga ditambahkan, memberi:
ΔHRX = 285.8 kJ/mol + (-101.2 kJ/mol) + (-1200.0 kJ/mol)
Ekspresi ini sama dengan awal:
ΔH = ΔH1 + ΔH2 + ΔH3
Jadi, kami memiliki ΔHRX sama dengan:
ΔHRX = -1015.4 kJ/mol
- Contoh 2
Dalam contoh ini, akan terlihat bahwa entalpi reaksi alternatif sesuai dengan entalpi pembentukan senyawa bunga.
Diinginkan untuk menentukan Δhrxn untuk reaksi dekomposisi berikutnya:
2so3(g) → 2so2(g) + atau2(G)
Dan entalpi pelatihan dari senyawa SO dihitung3 Dan sebagainya2:
S (S) + O2(g) → begitu2(g) (ΔH = -296.8 kJ/mol)
Dapat melayani Anda: isopreno: struktur, sifat, aplikasiS (s) + 3/2o2(g) → begitu3(g) (ΔH = -395.6 kJ/mol)
Persamaan Pemesanan
Latihan ini akan diselesaikan dengan cara yang sama seperti contoh sebelumnya. Seharusnya begitu3 Jadilah benar, dan kalikan dengan 2. Untuk itu, kita harus "mengubah" persamaan formasi SO3 Mengalikannya dengan -1, dan kemudian dengan mengalikannya dengan 2:
2so3(g) → 2s (s) + 3o2(g) (ΔH = -395.6 kJ/mol) * (-2)
Persamaan Formasi SO2 Kami juga mengalikannya dengan 2:
2s (s) + 2nd2(g) → 2so2(g) (ΔH = -296.8 kJ/mol) * (2)
Jumlah persamaan
Sekarang persamaan ditambahkan:
2so3(g) → 2s (s) + 3o2(g) (ΔH = 791.2 kJ/mol)
2s (s) + 2nd2(g) → 2so2(g) (ΔH = -593.6 kJ/mol)
2so3(g) → 2so2(g) + atau2(G)
Perhatikan bahwa istilah 2s dihilangkan karena berada di kedua sisi panah. Juga, ke -32 2o dikurangi2 memberikan o2. Jumlah entalpi, dan oleh karena itu, nilai Δhrxn adalah:
ΔH = ΔHRXN = 791.2 kJ/mol + (-593.6 kJ/mol)
= 197.6 kJ/mol
Seperti reaksi dekomposisi apa pun, itu adalah endotermik, jadi entalpi itu positif.
Metode alternatif
Ada metode untuk mencapai hasil yang sama dengan cara yang lebih langsung dan sederhana. Ini disebutkan di bagian sebelumnya.
2so3(g) → 2so2(g) + atau2(G)
Untuk menentukan Δhrxn dari reaksi ini, kita harus menghitung ΔHºF (reagen) dan ΔHºF (produk). ΔHºF (jadi3) sama dengan -395.6 kJ/mol, sedangkan ΔHºF (jadi2) sama dengan -296.8 kJ/mol. ΔHºF (atau2) sama dengan 0, karena oksigen dasar ada sebagai molekul O2 dan bukan sebagai atom atau gratis.
Jadi kita punya:
ΔHRXN = ΔHºF (Produk) - ΔHºF (reagen)
= [ΔHºF (jadi2) + ΔHºF (atau2)] - ΔHºF (jadi3)
= ΔHºF (jadi2) - ΔHºF (jadi3)
Namun, kita harus melipatgandakan kedua entalpi pelatihan dengan 2, untuk mencocokkan koefisien stoikiometrik sehubungan dengan persamaan kimia:
Δhrxn = 2ΔHºF (jadi2) - 2ΔHºF (jadi3)
Dan menghitung kami memiliki:
Δhrxn = 2 (-296.8 kJ/mol) - 2 (-395.6 kJ/mol)
= 197.6 kJ/mol
Faktanya, ini adalah cara yang biasanya lebih disukai untuk menyelesaikan semua latihan di mana hukum hess diterapkan.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2020). Hukum Hess. Diperoleh dari: di.Wikipedia.org
- Cohen Shelly. (18 Mei 2020). Hukum Hess. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Clark Jim. (2010). Hukum Hess dan Perhitungan perubahan entalpi. Pulih dari: chemguide.bersama.Inggris
- Helmestine, Anne Marie, PH.D. (11 Februari 2020). Definisi Hukum Hess. Pulih dari: thinkco.com
- Foist Laura. (2020). Hukum Hess: Definisi, Formula & Contoh. Belajar. Pulih dari: belajar.com
- Quimitube. (2014). Teori 14 Thermochemistry: Perhitungan entalpi reaksi oleh hukum Hess. Dipulihkan dari: Quimitube.com
- « Tes ketegangan bagaimana hal itu dilakukan, sifat, contoh
- Tes Kompresi Bagaimana dilakukannya, properti, contoh »

