Hukum banyak proporsi
- 4338
- 378
- Ernesto Mueller
Apa hukum banyak proporsi?
Itu Hukum banyak proporsi Itu menetapkan bahwa jika dua elemen membentuk lebih dari satu senyawa ketika mereka bereaksi satu sama lain, maka proporsi massa yang dengannya salah satu dari mereka dikombinasikan dengan massa yang tetap dari yang lain, itu sama dengan hubungan angka -angka kecil.
Pernyataan hukum mungkin tampak rumit jika Anda tidak memiliki contoh yang ada. Oleh karena itu pertimbangkan untuk beberapa kue Oreos, terdiri dari dua tutup cokelat dan strip krim manis: t2C (t = tutup dan c = krim). Jika kami ingin menciptakan kue Oreo yang lebih kuat, kami akan menambahkan strip krim lain, untuk mendapatkan krim ganda (t2C2 atau TC).
 Dalam makanan penutup, seperti cookie Oreos, kami memiliki proporsi yang dapat bervariasi hanya untuk menyiapkan versi lain dari mereka. Sumber: Brokensphere, CC BY-SA 3.0 https: // createveCommons.Org/lisensi/by-sa/3.0 via Wikimedia Commons
Dalam makanan penutup, seperti cookie Oreos, kami memiliki proporsi yang dapat bervariasi hanya untuk menyiapkan versi lain dari mereka. Sumber: Brokensphere, CC BY-SA 3.0 https: // createveCommons.Org/lisensi/by-sa/3.0 via Wikimedia Commons Kami juga bisa menambahkan satu lagi, sehingga kue memiliki tiga kali lebih banyak krim daripada kue konvensional (t2C3). Bagaimana jika kita meletakkan tutup cokelat lain di tengah garis putih (t3C2)? Opsi tidak terbatas; Tapi kami selalu menambahkan tutup atau unit krim. Kami tidak memikirkan setengah dari tutupnya (1/2 t), atau seperlima krim (1/5 C), karena itu tidak pantas.
Dengan cara yang sama hal itu terjadi dengan elemen kimia: atom -atomnya tidak membelah untuk membentuk senyawa. Oleh karena itu, massa T atau C di antara senyawa mereka "selalu" hubungan sederhana.
Penjelasan
Proporsi
Hukum proporsi berganda, bersama dengan hukum proporsi yang ditentukan, mendahului stoikiometri dan formula kimia pertama. Mari kita lupakan cookie, tapi mari kita simpan simbol mereka: t dan c. Melalui percobaan, ditemukan bahwa elemen T dan C membentuk beberapa senyawa: t2C, TC dan T2C3.
Sebelum formula kimia tidak mungkin diketahui sekaligus yang merupakan proporsi massa T dan C dalam senyawa tersebut. Pertama -tama harus menentukan mereka. Dalam sebuah kompleks, ditemukan bahwa massa T berlipat ganda menjadi C; Untuk mengatakan, 2 gram T dikombinasikan dengan 1 gram C.
Dapat melayani Anda: kapasitansi: unit, rumus, perhitungan, contohKemudian, di kompleks lain massa T dan C harus dicocokkan: 2 gram T sekarang dikombinasikan dengan 2 gram C. Di sini muncul pertanyaan: Bagaimana jika T dan C masih dapat membentuk senyawa lain? Jika demikian, itu pasti akan dibentuk dengan 2 gram T, tetapi kali ini mereka akan dikombinasikan dengan 3 gram C (1 gram + 1 gram + 1 gram).
Hubungan massa sederhana
Proporsi massa yang bereaksi T dan C memungkinkan untuk menetapkan formula kimianya: t2C (2 gram t: 1 gram C), tc (2 gram t: 2 gram c) dan t2C3 (2 gram t: 3 gram c). Jika kita ingin membandingkan hubungan massa T atau C dalam senyawa ini, perlu bahwa salah satu massanya tetap konstan; Dalam hal ini T: 2 gram.
Oleh karena itu, kami akan menentukan proporsi massa C dalam tiga senyawa ini:
- T2C: 1 gram C/2 gram t
- TC: 2 gram c/2 gram t
- T2C3: 3 gram c/2 gram t
Kami akan memiliki hubungan untuk massa C sama dengan 1: 2: 3. Yaitu, ada 2 kali lebih C di TC daripada di t2C, dan 3 kali lebih c di t2C3 daripada di t2C. Seperti dapat dilihat, 1: 2: 3 adalah bilangan bulat kecil (mereka bahkan tidak melebihi selusin).
Contoh Hukum Berbagai Proporsi
Untuk contoh -contoh berikut, langkah -langkah sebelumnya yang sama akan diterapkan, tetapi kami akan memperhitungkan massa molar dari masing -masing elemen, dengan asumsi satu mol senyawa.
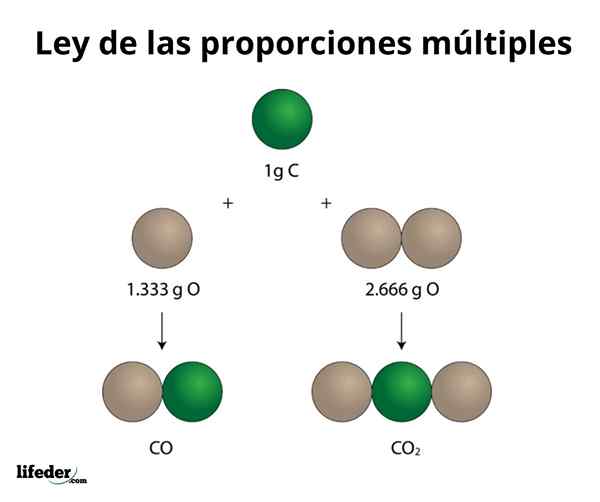
KELAPA2

Contoh ini menjelaskan dengan cara sederhana bagaimana hukum banyak proporsi bekerja; Dalam CO (karbon monoksida), ada 1.333 gram oksigen untuk setiap gram karbon. Dalam karbon dioksida (CO₂), ada 2.666 gram oksigen untuk setiap gram karbon. Oleh karena itu, proporsi oksigen di kedua senyawa adalah 1: 2, jumlah bilangan bulat kecil.
H2OH2SALAH SATU2
Undang -undang proporsi berganda berlaku untuk sepasang h2OH2SALAH SATU2.
Dapat melayani Anda: 30 contoh suspensi kimiaDalam mol H2Atau, 2 gram hidrogen dikombinasikan dengan 16 gram oksigen. Sementara itu, dalam mol H2SALAH SATU2, 2 gram hidrogen dikombinasikan dengan 32 gram oksigen. Untuk memverifikasi jika undang -undang ini terpenuhi, kita harus menetapkan massa yang sama untuk salah satu elemen di kedua senyawa. Kali ini adalah hidrogen: 2 gram.
Proporsi massal untuk h2Atau dan h2SALAH SATU2 adalah:
- H2O: 16 gram atau/2 gram h
- H2SALAH SATU2: 32 gram atau/2 gram h
Rasio massa O akan menjadi 16:32. Namun, kita dapat menyederhanakannya dengan membagi dengan 16, tetap 1: 2. Sekali lagi, hubungan terakhir terdiri dari bilangan bulat kecil.
Sw2-Sw3
Di mol begitu2, 32 gram belerang dikombinasikan dengan 32 gram oksigen. Sementara itu, dalam mol begitu3, 32 gram belerang dikombinasikan dengan 48 gram oksigen. Massa belerang adalah sama untuk kedua senyawa, sehingga kita dapat secara langsung membandingkan proporsi oksigen:
- Sw2: 32 gram atau
- Sw3: 48 gram atau
Menjadi rasio massa oksigen antara kedua senyawa yang sama dengan 32:48 atau 1: 1.5. Tapi tidak ada bahwa harus ada bilangan bulat? Hubungan 1: 1.5 (1/1.5) Ini juga dapat ditulis sebagai 2: 3 (0.6), dan sekali lagi kita akan memiliki bilangan bulat kecil: 2 dan 3.
Perhatikan bahwa kita juga bisa menulis hubungan sebagai 48:32 atau 1.5: 1, menjadi hasilnya 3: 2. Hukum tidak berubah, hanya interpretasi hubungan: ada 1.5 atau 3/2 kali lebih banyak oksigen di SO3 itu di SO2; yang sama untuk mengatakan bahwa ada 2/3 atau 0.6 kali lebih sedikit oksigen di SO2 itu di SO3.
TIDAK TIDAK2-N2PADA2SALAH SATU3-N2SALAH SATU5
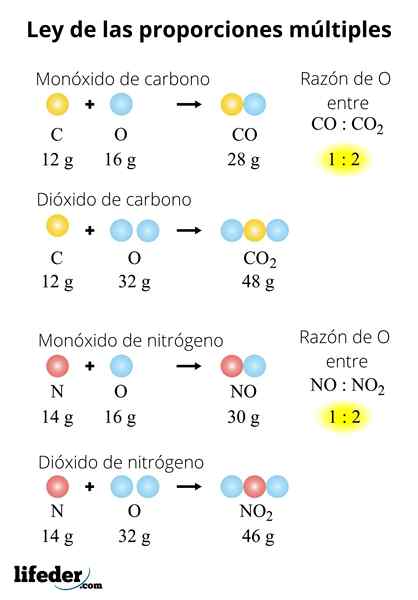
Undang -undang juga dapat diterapkan untuk serangkaian senyawa. Pertimbangkan nitrogen oksida: tidak-tidak2-N2PADA2SALAH SATU3-N2SALAH SATU5. Untuk mengevaluasi undang -undang ini di dalamnya, kita harus menetapkan massa nitrogen: 28 gram. Karena? Karena tidak dan tidak2 Mereka memiliki atom nitrogen kurang dari oksida lainnya:
- 2 (tidak): 28 gram N/32 gram atau
- 2 (tidak2): 28 gram n/64 gram atau
- N2O: 28 gram n/ 16 gram atau
- N2SALAH SATU3: 28 gram N/ 48 gram atau
- N2SALAH SATU5: 28 gram N/ 80 gram atau
Mari kita lupakan nitrogen dan fokus pada gram oksigen:
- 2 (tidak): 32 gram atau
- 2 (tidak2): 64 gram atau
- N2O: 16 gram atau
- N2SALAH SATU3: 48 gram atau
- N2SALAH SATU5: 80 gram atau
Menjadi rasio massa atau sama dengan 32: 64: 16: 48: 80. Untuk menyederhanakannya, kami membagi semua angka di antara yang terkecil, 16, menjadi 2: 4: 1: 3: 5.
Yaitu, ada: 2 kali lebih banyak oksigen di NO daripada di n2Atau, 4 kali lebih banyak oksigen di no2 itu di n2Atau, 3 kali lebih banyak oksigen di n2SALAH SATU3 itu di n2Atau, dan 5 kali lebih banyak oksigen di N2SALAH SATU5 itu di n2SALAH SATU. Sekali lagi, kami memiliki bilangan bulat kecil, mulai dari 1 hingga 5.
Batasan
Hukum proporsi berganda tidak selalu terpenuhi. Misalnya, massa molar atau bobot atom dari unsur -unsur bukanlah seluruh angka, tetapi memiliki banyak desimal. Ini sepenuhnya memodifikasi hubungan yang dihitung, yang berhenti menjadi sederhana.
Demikian juga, hukum tidak terpenuhi untuk senyawa berat, seperti beberapa hidrokarbon. Misalnya, undecano, csebelasH24, memiliki 1.0083 atau 121/120 kali lebih banyak hidrogen daripada dekan, c10H22, yang hubungannya terdiri dari 121 dan 120, yang melebihi selusin; Mereka bukan bilangan bulat kecil.
Dan akhirnya, hukum gagal dengan senyawa non -stoikiometri, seperti halnya banyak oksida dan sulfida.
Kesimpulan
Undang -undang proporsi berganda menyatakan bahwa ketika dua elemen membentuk lebih dari satu senyawa, massa yang berbeda dari suatu unsur yang bergabung dengan massa yang sama dari elemen lain berada dalam proporsi sejumlah kecil.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2020). Hukum banyak proporsi. Diperoleh dari: di.Wikipedia.org
- Para editor Eeritlopaedia Britannica. (2020). Hukum banyak proporsi. Dipulihkan dari: Britannica.com
- ChemistryGod. (4 Juni 2019). Hukum proporsi berganda oleh Dalton. Pulih dari: chemistrygod.com
- Garcia Nissa. (2020). Hukum banyak proporsi: Definisi & contoh. Belajar. Pulih dari: belajar.com

