Massa molar bagaimana itu dihitung, contoh dan latihan diselesaikan
- 959
- 151
- Miss Marion Graham
Itu Masa molar Ini adalah sifat intensif materi yang menghubungkan konsep pengukuran mol dengan massa. Menjadi lebih ringkas, itu adalah jumlah massa yang sesuai dengan mol zat; yaitu, apa yang "menimbang" angka avogadro, (6.022 · 1023) partikel -partikel tertentu.
Satu mol zat apa pun akan mengandung jumlah partikel yang sama (ion, molekul, atom, dll.); Namun, massa akan bervariasi karena dimensi molekulnya ditentukan oleh jumlah atom dan isotop yang membentuk strukturnya. Semakin banyak massa atom atau molekul, semakin besar massa molarnya.
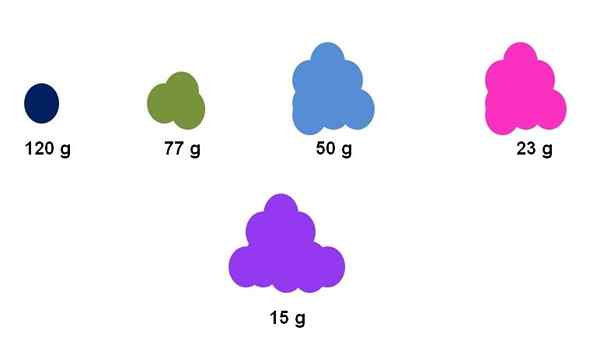
 Perbedaan antara massa molar dari berbagai zat dapat diperhatikan secara dangkal dengan jumlah sampelnya yang jelas. Sumber: Gabriel Bolívar.
Perbedaan antara massa molar dari berbagai zat dapat diperhatikan secara dangkal dengan jumlah sampelnya yang jelas. Sumber: Gabriel Bolívar. Misalnya, misalkan tepat satu mol bertemu untuk lima senyawa yang berbeda (gambar superior). Menggunakan keseimbangan, adonan telah diukur untuk setiap cluster, dinyatakan di bawah. Massa ini sesuai dengan adonan molar. Dari semuanya, senyawa ungu adalah yang dengan partikel yang lebih ringan, sedangkan senyawa biru tua, partikel terberat.
Perhatikan bahwa kecenderungan umum dan berlebihan ditunjukkan: semakin besar massa molar, semakin rendah jumlah sampel yang harus ditempatkan dalam keseimbangan. Namun, volume materi ini juga sangat tergantung pada keadaan agregasi masing -masing senyawa dan kepadatannya.
[TOC]
Bagaimana adonan molar dihitung?

Definisi
Massa molar dapat dihitung dari definisi: jumlah massa per mol zat:
M = gram zat /mol zat
Faktanya, g/mol adalah unit di mana massa molar biasanya diekspresikan, di sebelah kg/mol. Jadi, jika kita tahu berapa banyak tahi lalat yang kita miliki tentang senyawa atau elemen, dan kita menimbangnya, kita akan mencapai massa molar yang menerapkan divisi sederhana.
Dapat melayani Anda: Justus von LiebigItem
Massa molar tidak hanya berlaku untuk senyawa, tetapi juga untuk unsur -unsur tersebut. Konsep tahi lalat tidak membedakan sama sekali. Oleh karena itu, dengan bantuan tabel periodik kami menempatkan massa atom relatif untuk unsur yang menarik, dan melipatgandakan nilainya dengan 1 g/mol; Ini, konstan Avogadro, MATAU.
Misalnya, massa atom relatif strontium adalah 87,62. Jika kita ingin memiliki massa atomnya, itu akan menjadi 87,62 UMA; Tetapi jika yang kita cari adalah massa molarnya, maka itu akan menjadi 87,62 g/mol (87,62 · 1g/mol). Maka, massa molar dari semua elemen lain diperoleh dengan cara yang sama, tanpa membuat perkalian seperti itu.
Senyawa
Massa molar suatu senyawa tidak lebih dari jumlah massa atom relatif dari atomnya dikalikan MATAU.
Misalnya, molekul air, h2Atau, ia memiliki tiga atom: dua hidrogen dan satu oksigen. Massa atom relatif masing -masing adalah 1.008 dan 15.999. Dengan demikian, kami menambahkan massa yang dikalikan dengan angka atom yang ada dalam molekul senyawa:
2 H · (1.008) = 2.016
1 o · (15.999) = 15.999
M(H2O) = (2.016 + 15.999) · 1g/mol = 18.015 g/mol
Ini adalah praktik yang cukup umum untuk dihilangkan MATAU pada akhirnya:
M(H2O) = (2.016 + 15.999) = 18.015 g/mol
Dipahami bahwa adonan molar memiliki unit g/mol.
Contoh
Salah satu massa molar paling terkenal baru saja disebutkan: air, 18 g/mol. Mereka yang menjadi terbiasa dengan perhitungan ini, mencapai titik di mana mereka mampu menghafal beberapa massa molar tanpa mencarinya atau menghitungnya seperti yang dilakukan. Beberapa massa molar ini, yang berfungsi sebagai contoh, adalah sebagai berikut:
Itu dapat melayani Anda: Keuntungan dan Kekurangan Kimia Kesehatan-SALAH SATU2: 32 g/mol
-N2: 28 g/mol
-NH3: 17 g/mol
-Ch4: 16 g/mol
-BERSAMA2: 44 g/mol
-HCl: 36,5 g/mol
-H2Sw4: 98 g/mol
-Ch3COOH: 60 g/mol
-Iman: 56 g/mol
Perhatikan bahwa nilai yang diberikan dibulatkan. Untuk tujuan yang lebih tepat, massa molar dengan desimal yang lebih baik harus diekspresikan dan dihitung dengan massa atom relatif yang tepat dan tepat.
Latihan terpecahkan
Latihan 1
Melalui metode analitik, diperkirakan bahwa solusi sampel mengandung 0,0267 mol analit D. Diketahui juga bahwa massanya sesuai dengan 14% dari sampel yang totalnya massa adalah 76 gram. Hitung massa molar dari dugaan analit d.
Kita harus menentukan massa D yang dilarutkan dalam larutan. Kami melanjutkan:
Massa (d) = 76 g · 0,14 = 10,64 g d
Yaitu, kami menghitung 14% dari 76 gram sampel, yang sesuai dengan gram analit D. Kemudian, dan akhirnya, kami menerapkan definisi massa molar, karena kami memiliki data yang cukup untuk menghitungnya:
M(D) = 10,64 g D/ 0,0267 mol D
= 398.50 g/mol
Apa yang diterjemahkan seperti: satu mol (6.022 · 1023) Dari dan memiliki massa yang sama dengan 398.50 gram. Berkat nilai ini, kami dapat mengetahui berapa banyak dan kami ingin mempertimbangkan keseimbangan jika kami ingin, misalnya, menyiapkan solusi konsentrasi molar 5 · 10-3 M; yaitu, larut 0,1993 gram dan dalam satu liter pelarut:
5 · 10-3 (mol/l) · (398,50 g/mol) = 0,1993 g dan
Latihan 2
Hitung massa molar asam sitrat mengetahui bahwa formula molekulnya adalah C6H8SALAH SATU7.
Formula C yang sama6H8SALAH SATU7 Ini memfasilitasi pemahaman tentang perhitungan, karena memberi tahu kita begitu jumlah atom C, h dan atau bahwa ada asam jeruk. Karena itu, kami mengulangi langkah yang sama untuk air:
Dapat melayani Anda: dodecil natrium sulfate (SDS): struktur, sifat, penggunaan6 C · (12.0107) = 72.0642
8 H · (1.008) = 8.064
7 o · (15.999) = 111.993
M(asam sitrat) = 72.0642 + 8.064 + 111.993
= 192.1212 g/mol
Latihan 3
Hitung adonan molar tembaga pentahidrat sulfat, cuo4· 5h2SALAH SATU.
Kita tahu sebelum massa air molar adalah 18.015 g/mol. Ini berfungsi untuk menyederhanakan perhitungan, karena kami menghilangkannya untuk saat ini dan fokus pada garam anhidrat Cuo4.
Kami memiliki bahwa massa atom relatif tembaga dan belerang masing -masing adalah 63.546 dan 32.065. Dengan data ini, kami melanjutkan dengan cara yang sama seperti dengan Latihan 2:
1 Cu · (63.546) = 63.546
1 s · (32.065) = 32.065
4 o · (15.999) = 63.996
M(Cuso4) = 63.546 + 32.065 + 63.996
= 159.607 g/mol
Tapi kami tertarik pada adonan molar garam pentahidrat, bukan anhidrat. Untuk melakukan ini, kita harus menambah hasil massa air yang sesuai:
5 jam2O = 5 · (18.015) = 90.075
M(Cuso4· 5h2O) = 159.607 + 90.075
= 249.682 g/mol
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2020). Masa molar. Diperoleh dari: di.Wikipedia.org
- Nissa Garcia. (2020). Apa itu massa molar? Definisi, Formula & Ujian. Belajar. Pulih dari: belajar.com
- Kata. Kristy m. Kebun istana. (S.F.). Tutorial stoikiometri
Menemukan massa molar. Diperoleh dari: OCC.Edu - Helmestine, Anne Marie, PH.D. (2 Desember 2019). Masalah Contoh Massa Molar. Pulih dari: thinkco.com
- « Penemuan, struktur, properti, penggunaan Darmstadtio
- Tahapan dan kepentingan siklus air atau hidrologi »

