Metode penyeimbangan aljabar (dengan contoh)

- 4547
- 498
- Mr. Darrell Streich
Dia Metode keseimbangan aljabar Ini digunakan dalam kimia untuk mencocokkan jumlah atom di kedua sisi reaksi kimia. Reaksi kimia yang ditulis dengan benar, harus memiliki formula dari semua reagen yang berpartisipasi di sisi kiri dan produk, juga dengan formula mereka, di sisi kanan.
Namun, ketika Anda memiliki reaksi, jumlah atom dalam rumus reagen sama dengan masing -masing atom dalam rumus produk tidak selalu tidak selalu.
 Gambar 1. Metode penyeimbangan aljabar adalah alat sederhana untuk menyeimbangkan persamaan kimia. Sumber: f. Zapata.
Gambar 1. Metode penyeimbangan aljabar adalah alat sederhana untuk menyeimbangkan persamaan kimia. Sumber: f. Zapata. Namun, adonan dilestarikan. Misalnya, mari kita lihat reaksi berikut:
Kcl3 → kcl + o2
Persamaan ini memiliki senyawa yang disebut kalium klorat, yang dipecah dengan pemanasan dalam kalium klorida dan oksigen gas. Tetapi ketika menonton dengan hati -hati, kami melihat bahwa dalam molekul klorat ada 3 atom oksigen, sementara di sebelah kanan hanya ada satu molekul oksigen gas dengan 2 atom.
Apa yang kemudian dilakukan adalah berkembang biak dengan koefisien numerik untuk reagen kiri, sehingga jumlah atom dari semua elemen yang berpartisipasi adalah sama sebelum dan sesudah reaksi.
Tapi ... apa nilai koefisien ini?
[TOC]
Cara Menyeimbangkan Persamaan
Dalam persamaan sebelumnya, mudah untuk menentukan koefisien yang sesuai dengan inspeksi. Jika kita berlipat ganda dengan 2 di sebelah kiri kita memiliki 2 atom k, 2 dari cl dan 6 dari o.
Oleh karena itu, di sebelah kanan kita melipatgandakan kalium klorida dengan 2 dan O2 dengan 3:
2 kclo3 → 2kcl + 3o2
Dan sekarang kita dapat melihat bahwa akuntansi benar di kedua sisi panah dan reaksinya seimbang. Perhatikan bahwa nilai numerik lainnya juga dapat menghasilkan persamaan yang seimbang, misalnya:
Dapat melayani Anda: Asam Borat: Struktur Kimia, Sifat, Persiapan, Penggunaan4 kclo3 → 4KCl + 6o2
Namun, himpunan seluruh angka minimum yang sama dengan jumlah atom di kedua sisi harus selalu dicari.
Angka -angka yang melipatgandakan setiap rumus disebut koefisien. Sangat penting untuk dicatat bahwa koefisien dapat ditugaskan untuk menyeimbangkan, tetapi subskrip harus tetap seperti yang muncul di setiap formula.
Koefisien juga tidak dapat dimasukkan di tengah formula masing -masing senyawa, karena itu akan mengubahnya.
Persamaan sederhana seperti contoh dapat diseimbangkan dengan inspeksi atau skor. Bagi mereka yang sedikit lebih kompleks ada metode aljabar dengan serangkaian langkah sederhana dan operasi aritmatika dasar yang dirinci di bawah ini.
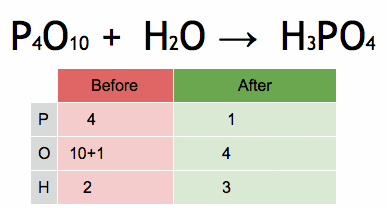 Gambar 2. Animasi yang menunjukkan keseimbangan persamaan kimia untuk mendapatkan asam fosfat. Sumber: Wikimedia Commons. Ephert/CC BY-SA (https: // createveCommons.Org/lisensi/by-sa/4.0)
Gambar 2. Animasi yang menunjukkan keseimbangan persamaan kimia untuk mendapatkan asam fosfat. Sumber: Wikimedia Commons. Ephert/CC BY-SA (https: // createveCommons.Org/lisensi/by-sa/4.0) Langkah -langkah untuk menyeimbangkan persamaan kimia secara aljabar
Langkah 1
-Tetapkan untuk setiap molekul koefisien sewenang -wenang, dilambangkan dengan surat. Lirik A, B, C, D .. ., seperlunya diperlukan.
Penting: Ingatlah bahwa hanya koefisien yang digunakan oleh molekul dan tidak pernah diselingi di tengahnya, selalu ditempatkan di sebelah kiri.
Langkah 2
-Buat daftar setiap elemen yang berpartisipasi.
Langkah 3
-Tempatkan koefisien atau koefisien yang ditetapkan untuk setiap senyawa ke kiri dan cocokkan di sebelah kanan. Jika ada subskrip, mereka berlipat ganda dengan koefisien untuk menemukan jumlah total atom.
Dan jika ada elemen yang ditemukan dalam lebih dari satu molekul, jumlah atom yang ada di setiap sisi ditambahkan. Dengan cara ini persamaan parsial dari setiap elemen.
Langkah 4
-Nilai numerik ditetapkan untuk salah satu koefisien. Biasanya nilai numerik ini adalah 1 dan ditugaskan untuk surat yang muncul lebih banyak kali. Ini mencapai persamaan sederhana yang berfungsi sebagai titik awal untuk menemukan koefisien lainnya.
Dapat melayani Anda: faktor pengenceranLangkah 5
-Tentukan nilai koefisien berikut dengan aritmatika sederhana dan ganti nilainya dalam persamaan lain, untuk meningkatkan yang baru.
Langkah 6
-Ulangi langkah sebelumnya untuk mengganti nilai dan membuat persamaan baru, sampai Anda menemukan semua koefisien.
Langkah 7
-Ganti nilai dengan demikian ditentukan. Jika nilai -nilai ini utuh, harus diverifikasi bahwa persamaannya seimbang. Jika mereka tidak utuh, itu dikalikan dengan kelipatan umum minimum dari denominator dan saldo diperiksa.
Kemudian kami akan memvisualisasikan penerapan langkah -langkah ini dalam resolusi beberapa contoh.
Contoh penyeimbangan terpecahkan
Contoh 1
Seimbangkan reaksi berikut jika perlu, melalui metode aljabar:
N2SALAH SATU5 → n2SALAH SATU4 + SALAH SATU2
Larutan
Kami mengamati bahwa reaksinya tidak seimbang, karena meskipun ada 2 atom nitrogen di kedua sisi, dengan oksigen jumlah di sebelah kiri dan kanan berbeda.
Kemudian kita harus mengikuti langkah -langkah yang dijelaskan di bagian sebelumnya:
-Kami menulis persamaan lagi dan melipatgandakan setiap molekul dengan koefisien yang berbeda. Huruf kecil dipilih sehingga tidak bingung dengan elemen:
A⋅n2SALAH SATU5 → B⋅n2SALAH SATU4 + C⋅o2
-Sekarang kami mencantumkan setiap elemen dan mencocokkan jumlah elemen itu ke kiri dan kanan. Ini adalah persamaan parsial untuk setiap elemen:
- A⋅n2 = B⋅n2
- A⋅o5 = B⋅o4 + C⋅o2
-Mengalikan koefisien dan subskrip kami memperoleh jumlah atom nitrogen. Dari Persamaan 1 kita dapatkan:
2a = 2b
-Persamaan 2 memiliki Ke -5 atom oksigen ke kiri, saat di sebelah kanan ada 4b Dan 2 c:
5a = 4b + 2c
-Kami menetapkan nilai 1 untuk koefisien a, dengan cara ini:
A = 1
Pilihan ini sewenang -wenang, bisa juga dipilih pertama b = 1.
-Nilai -nilai ini diganti dalam Persamaan 2, untuk menentukan nilai C:
Itu bisa melayani Anda: cupric oxide (cuo)5 = 4 + 2c
2c = 5-4 = 1
C = ½
-Kami mengganti koefisien dalam persamaan asli, 1 tidak perlu menulisnya secara eksplisit:
N2SALAH SATU5 → n2SALAH SATU4 + ½ o2
-Karena lebih disukai bahwa koefisien menjadi utuh, seluruh persamaan dikalikan dengan kelipatan umum minimum dari penyebut, yaitu 2 dan 1:
M.C.M. (1.2) = 2
Kemudian, dengan mengalikan kiri dan kanan dengan 2, diperoleh:
2n2SALAH SATU5 → 2n2SALAH SATU4 + SALAH SATU2
Dan kami menghitung jumlah atom di kedua sisi, untuk memeriksa saldo:
- N di sebelah kiri: 4
- Atau kiri: 10
- N ke kanan: 4
- Atau kanan: 8 + 2 = 10
Contoh 2
Menyeimbangkan reaksi kimia berikut:
Nahco3 → Na2BERSAMA3 + H2Atau + co2
Larutan
Kami melipatgandakan setiap molekul dengan koefisien yang berbeda:
A ⋅ nahco3 → B⋅na2BERSAMA3 + C⋅H2O + d⋅co2
Kemudian kami mengusulkan akuntansi setiap elemen ke kanan dan ke kiri panah. Ada total 4 elemen dalam reaksi: natrium na; Hidrogen H; mobil mobil dan oksigen atau, semua harus dihitung:
- A⋅na = b⋅na2
- a⋅h = c⋅h2
- A⋅c = b⋅c + d⋅c
- A⋅o3 = B⋅o3+C⋅o+d⋅o2
Menurut setiap saldo, persamaan berikut diperoleh:
1) a = 2b
2) a = 2c
3) a = b + d
4) a = 3b + c + 2d
Koefisien yang paling berulang adalah ke, Oleh karena itu kami menetapkan nilai 1:
A = 1
Jadi:
1) a = 2b ⇒ b = ½
2) a = 2c ⇒ c = ½
3) A = B + D ⇒ D = A - B = 1 - ½ = ½
Kami mengganti koefisien dalam persamaan:
Nahco3 → ½. Na2BERSAMA3 + ½. H2O + ½.BERSAMA2
Kami berlipat ganda di kedua sisi panah dengan 2, karena itu adalah satu -satunya penyebut yang hadir, untuk menghilangkan fraksi:
2Nahco3 → Na2BERSAMA3 + H2Atau + co2
Kami menghitung jumlah atom yang ada di sebelah kiri: 2 atom Na, H dan C dan 6 dari O. Pembaca dapat memverifikasi bahwa masing -masing juga ada di sebelah kanan dalam jumlah yang sama.
Referensi
- Atkins, hlm. Prinsip Kimia: Jalan Penemuan. Editorial medis Pan -American. Edisi ke -3.
- Briceño, J. Panduan Kimia USB. Pulih dari: gecousb.com.pergi.
- Chang, R. 2013. Kimia. 11va. Edisi. Pendidikan MC Graw Hill.
- Latihan terpecahkan. Balancing aljabar. Diperoleh dari: Latihan Cuelted.bersama.
- Simoza, l. Menyeimbangkan persamaan kimia. Pulih dari: guao.org.

