Potassium nitrite (KNO2) Struktur, sifat dan penggunaan

- 3178
- 740
- Pete Lesch
Dia Kalium nitrit Ini adalah garam anorganik yang formula kimianya seperti2, yang secara kimia dan farmakologis terkait dengan kalium nitrat3. Penampilan fisiknya terdiri dari kristal putih kekuningan, sangat higroskopis, dan karena itu, hidangan; yaitu, mereka larut dengan cepat di lingkungan yang lembab.
Formulanya menunjukkan bahwa proporsi ion k+ dan tidak2- Ini adalah 1: 1, dan tetap disatukan oleh gaya elektrostatik atau dengan tautan ionik. Sumber alami murni tampaknya belum ditemukan untuk kristal mereka, meskipun anion yang niter dapat ditemukan di tanah, pupuk, tanaman dan hewan.
 Kalium Nital Kristal. Sumber: leiem [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Kalium Nital Kristal. Sumber: leiem [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Gambar atas menunjukkan bagaimana tampilan kristal Kno2, Dengan nada kuning yang diucapkan. Jika kristal -kristal ini dibiarkan bersentuhan dengan udara, mereka akan menyerap kelembaban untuk menjadi larutan berair; Solusi yang telah menghasilkan kontroversi sehubungan dengan apakah penggunaannya bermanfaat atau tidak.
Di sisi lain, kristal -kristalnya, dalam jumlah yang sangat kecil (200 ppm), digunakan untuk salinisasi daging dan menjamin konservasi mereka terhadap aksi bakteri. Juga, Kno2 Meningkatkan warna daging, mengubahnya lebih kemerahan; Namun, ini tunduk pada beberapa pembatasan untuk menghindari efek toksik dari garam ini pada tubuh.
[TOC]
Struktur Kalium Nitrit
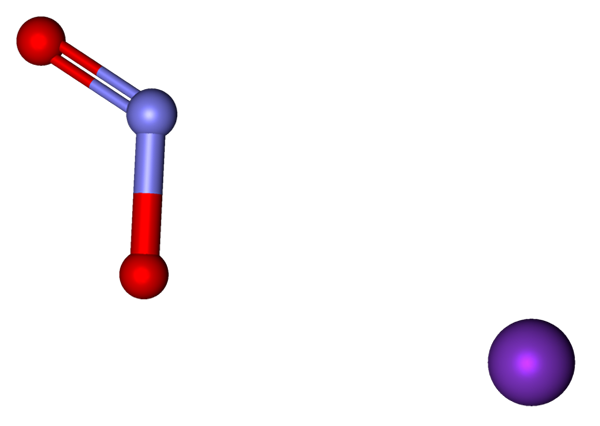 Ion yang membentuk KNO2 diwakili dengan model bola dan batang. Sumber: Marinavladivok [CC0].
Ion yang membentuk KNO2 diwakili dengan model bola dan batang. Sumber: Marinavladivok [CC0]. Ion yang ada dalam kalium nitrit ditunjukkan di atas. Kation k+ sesuai dengan bola ungu, sedangkan anion tidak2- Itu diwakili oleh bola kebiruan dan merah.
Anion no2- Ini ditunjukkan dengan ikatan rangkap dan yang sederhana [o = n-o]-; Namun pada kenyataannya, kedua tautannya sama sebagai hasil dari resonansi beban negatif di antara mereka.
Ion k+ dan tidak2- Mereka saling menarik di ruang angkasa untuk mengatur pola struktural dengan energi paling sedikit; Ini adalah, di mana tolakan antara beban yang sama minimal. Dan kristal Kno percaya2, yang sel unitnya rentan terhadap perubahan suhu, transisi fase mana.
Dapat melayani Anda: Stanislao CannizzaroMisalnya, pada suhu rendah (kurang dari 25 ° C) kristal Kno2 mengadopsi sistem monoklinik (fase I). Ketika suhu melebihi 25 ° C, transisi fase monoklinik rhomboébic terjadi (fase II). Akhirnya, di atas 40 ° C kristal Kno2 Perubahan menjadi kubik (fase III).
Juga, Kno2 dapat menunjukkan fase kristal lainnya (Fase IV, V dan VI) di bawah tekanan tinggi. Dengan ini, k ion+ dan tidak2- Mereka akhirnya bergerak dan memesan dengan cara yang berbeda dalam kristal murni mereka.
Properti
Massa molekul
85.1038 g/mol.
Kepadatan
1.9150 g/ml.
Titik lebur
440.02 ° C (tetapi mulai rusak dari 350 ° C, mengeluarkan asap beracun).
Titik didih
537 ° C (ledakan).
Kelarutan air
312 g/ 100 g air pada 25 ° C.
Hidangan lezat
Kelarutannya dalam air sedemikian rupa sehingga higroskopis; Begitu banyak, yang menunjukkan makanan lezat, menyerap kelembaban yang cukup untuk larut. Afinitas untuk air ini mungkin disebabkan oleh stabilitas energi yang diperoleh ion K+ Saat melembabkan, serta entalpi jaringan kristal rendah untuk kristal kno2.
Kristal dapat menyerap air tanpa larut untuk menjadi hidrat2· H2SALAH SATU. Dalam hidrat, molekul air menyertai ion, yang memodifikasi struktur kristal.
Hidrat ini (atau beberapa di antaranya) dapat dibentuk di bawah -9 ° C; Pada suhu yang lebih tinggi, air larut dan melembabkan ion, merusak kaca.
Kelarutan dalam pelarut lain
Sedikit larut dalam alkohol panas, dan sangat larut dalam amonia.
ph
6-9. Solusi berairnya karenanya alkali, karena anion tidak2- Itu bisa dihidrolisis.
Tata nama
Untuk Kno2 Itu juga dapat disebutkan namanya dengan cara lain. 'Kalium nitrit' sesuai dengan nama untuk garam ini sesuai dengan nomenklatur stok; 'Kalium nitrito', menurut nomenklatur sistematis, di mana satu -satunya valensi kalium, +1 disorot; dan dioksiitrat (iii) kalium, menurut nomenklatur sistematis.
Itu dapat melayani Anda: dibenzalacetona: sifat, mekanisme reaksi, penggunaan, risikoKalium 'Dioxonitrate (III), menyoroti valensi +3 dari atom nitrogen. Bahkan nama yang paling direkomendasikan oleh IUPAC untuk Kno2, 'Kalium Nitrite' terus menjadi yang paling nyaman dan termudah untuk diingat.
Memperoleh
Cara paling langsung untuk mensintesisnya, tetapi dengan kinerja yang lebih rendah, adalah melalui dekomposisi termal kalium nitrat atau garam pada suhu 400 ° C atau lebih:
2kno3 => Kno2 + SALAH SATU2
Namun, bagian dari Kno2 akhirnya membusuk dengan panas, selain produk lain.
Metode lain untuk menyiapkan atau mensintesisnya dengan kinerja yang lebih tinggi adalah dengan mengurangi KNO3 Di hadapan timbal, tembaga atau seng. Persamaan untuk reaksi ini adalah sebagai berikut:
Kno3 + Pb => Kno2 + Pbo
Kalium dan nitrat timbal dicampur stoikiometri dalam wajan besi, di mana mereka bergabung dengan agitasi dan pemanasan yang konstan selama setengah jam. Timbal oksida (II) berwarna kuning, dan adonan yang dihasilkan panas dan diobati dengan air mendidih. Kemudian campuran campurannya.
Gelembung filter panas dengan karbon dioksida selama lima menit, yang akan mengendapkan karbonat timbal, PBCO3, tidak larut. Dengan cara ini memimpin memimpin selesai. Asam nitrat yang diencerkan ke penyaringan ditambahkan sampai pH netral, dibiarkan dingin, dan akhirnya air menguap sehingga kristal kno terbentuk2.
Aplikasi
Aditif dan reagen
Kalium nitrit digunakan sebagai aditif untuk menyembuhkan daging merah, mempertahankan rasanya dan lebih banyak warna waktu selama penyimpanan, sementara menunda aksi bakteri dan racun tertentu, seperti botulinik. Oleh karena itu, ini menunjukkan aksi antibakteri.
Kno2 Itu tidak teroksidasi, yang bereaksi dengan mioglobin daging dan, akibatnya, akhirnya memodifikasi warna merah alami. Kemudian, saat daging dimasak, ia memperoleh warna merah muda yang kuat dan khas.
Dapat melayani Anda: 20 contoh sublimasi dan karakteristik kimiaNamun, dalam kondisi tanpa menentukan Kno2 bereaksi dengan protein daging untuk menimbulkan nitrosamin, yang bisa menjadi karsinogenik.
Di sisi lain, Kno2 (Meskipun lebih disukai nano2) Ini adalah reagen analitik yang dapat digunakan dalam sintesis pewarna azoik (reaksi asam nitrat dengan amina aromatik), dan dalam analisis asam amino.
Penangkal
Sementara itu memiliki efek negatif, Kno2 Ini bertindak sebagai penangkal pada pasien yang beracun dengan sianida dan hidrogen sulfida. Mekanismenya adalah untuk mengoksidasi pusat -pusat iman2+ untuk iman3+ dari kelompok yang kami miliki dari hemoglobin, menghasilkan methemoglobin, yang kemudian bereaksi dengan anion CN- dan hs-.
Dokter
Dalam jus lambung perut, anion tidak2- Itu dikurangi menjadi tidak, yang diketahui memiliki aksi vasodilator, meningkatkan aliran darah. Di daerah lain dari tubuh di mana pH tidak cukup asam, beberapa enzim, seperti xanthina yang dioksidasi, bertanggung jawab untuk mengurangi non -2-.
Kno telah digunakan2 untuk mengobati penyakit dan penyakit seperti angina dada dan epilepsi (dengan efek samping yang sangat negatif).
Referensi
- Wikipedia. (2019). Kalium nitrit. Diperoleh dari: di.Wikipedia.org
- Prebchem. (2016). Persiapan kalium nitrit. Pulih dari: prepchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Nitrat anorganik dan nitrit dan kontrol tekanan darah, penelitian kardiovaskular, volume 89, edisi 3, 15 Februry 2011, halaman 492-498, doi.org/10.1093/CVR/CVQ309
- Pubchem. (2019). Kalium nitrit. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Formulasi Kimia. (2018). Kalium nitrit. Pulih dari: formulasi quimica.com
- Pusat Nasional untuk Memajukan Ilmu Terjemahan. (2011). Kalium nitrit. Pulih dari: obat -obatan.ncats.Io
- Richard J. Eley, Paul B. Addis, dan Joseph J. WARTHEEN. (1992). Nitrit dalam daging. Universitas Minnesota.
- N. R. Rao, b. Prakash, dan m. Natarajan. (1975). Transformasi struktur kristal dalam nitrit anorganik, nitrat, dan karbonat. Departemen Kimia, Institut Teknologi India, Kanpur, India.
- « Karakteristik, tipe, masalah, dan contoh pidato politik
- Penyebab, konsekuensi, dan contoh polusi sampah »

