Sifat nitrit, struktur, nomenklatur, pelatihan
- 4917
- 1421
- Herbert Fritsch
Itu nitrit Mereka semua senyawa yang tidak mengandung anion2-, Jika mereka anorganik, atau kelompok -ono, jika mereka organik. Sebagian besar adalah nitrit logam, yang merupakan garam anorganik di mana tidak2- berinteraksi secara elektrostatik dengan kation CN+; Misalnya, kation natrium, na+.
Jadi, natrium nitrit, nano2, Ini adalah contoh senyawa garam atau nitrit. Garam -garam ini ditemukan di alam, baik di tanah, laut, mamalia dan jaringan tanaman, karena mereka adalah bagian dari siklus biologis nitrogen. Oleh karena itu, tidak2- Ini adalah zat yang ada dalam organisme kita, dan terkait dengan proses vasodilator.
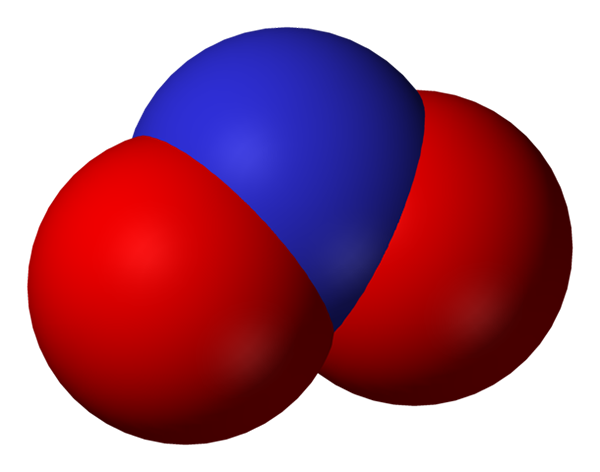
 Ruang penuh anion nitrit. Sumber: Benjah-BMM27.
Ruang penuh anion nitrit. Sumber: Benjah-BMM27. Nitrit menjadi bentuk nitrogen yang lebih kecil, atau lebih sedikit teroksidasi, daripada nitrat, bukan3-. Nitrat oksida terjadi darinya, tidak ada di daerah organisme di mana ada kekurangan oksigen. Dia bukan molekul pensinyalan yang memberikan efek vasodilator dengan merilekskan otot dan arteri.
Keluar dari biokimia dan kedokteran, nitrit digunakan sebagai bakterisida, menjadi agregasinya terhadap daging yang cukup umum. Ini dengan tujuan menyembuhkan mereka dan memperluas kualitas dan kesegaran mereka lebih lama.
Nitrit memiliki dua wajah: satu bermanfaat bagi kesehatan, dan satu lagi yang menempatkannya dalam bahaya. Wajah yang baik justru karena reaksi yang menguranginya menjadi tidak. Sementara itu, wajah yang buruk adalah karena transformasi menjadi nitrosamin: keluarga senyawa organik yang memiliki beberapa anggota yang telah diakui sebagai zat karsinogenik.
[TOC]
Properti Nitrit
Basa
Nitrit adalah garam dasar, karena anion tidak2- Itu adalah basa terkonjugasi dari asam nitrat, hno2:
Hno2 + H2Atau ⇌ tidak2- + H3SALAH SATU+
Dalam air dan dalam beberapa jumlah dihidrolisis untuk berasal dari ion OH-:
TIDAK2- + H2Atau ⇌ hno2 + Oh-
Basa ini intrinsik untuk semua garam nitrit, karena tidak tergantung pada2- dan bukan dari kation yang menyertainya. Namun, kation ini dan interaksinya dengan no2- Mereka mempengaruhi kelarutan garam nitrit dalam air dan pelarut kutub lainnya.
Reaksi
Reaksi nitrit bervariasi tergantung pada kation mana yang menyertai tidak2-, atau apakah itu nitrit organik, rono. Secara umum, nitrit dapat menguraikan, mengoksidasi atau mengurangi menjadi: logam oksida, bukan3-, TIDAK2, Tidak, dan bahkan gas nitrogen, n2.
Dapat melayani Anda: proses termodinamikaMisalnya, amonium nitrit, NH4TIDAK2 bisa membusuk ke n2 dan H2SALAH SATU.
Penampilan fisik
Hampir semua nitrit adalah padatan penampilan kristal. Banyak warna keputihan atau kekuningan, meskipun ada warna -warni jika mengandung kation logam transisi.
Di sisi lain, kebanyakan nitrit organik sangat tidak stabil dan cairan volatile yang sangat tidak stabil.
Struktur
Anion nitrit
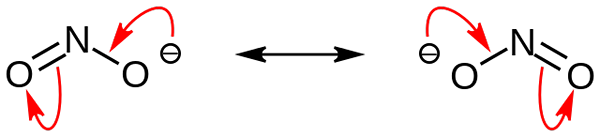 Struktur resonansi anion nitrit. Sumber: Domain Noingserius / Pub
Struktur resonansi anion nitrit. Sumber: Domain Noingserius / Pub Pada gambar pertama anion nitrit ditunjukkan dengan model ruang penuh. Model ini memiliki kelemahan yang persis sama dengan nitrogen dioksida, tidak2. Di sisi lain, gambar superior menggambarkan anion nitrit lebih baik dan bagaimana beban negatifnya berperilaku.
Beban ini dipindahkan antara dua atom oksigen, jadi masing-masing memiliki setengah dari beban negatif tersebut (-1/2). Dan beban negatif inilah yang bertanggung jawab untuk menarik kation di sekitarnya karena daya tarik elektrostatik yang sederhana.
Padatan
Nitrit anorganik adalah semua senyawa padat kristal. Interaksinya murni elektrostatik, memiliki ketertarikan antara no2- dan kation mN+. Jadi, misalnya, nano2 Ini memiliki struktur kristal ortorombik, dan dibentuk oleh ion na+ dan tidak2-.
Jenis struktur kristal akan tergantung pada identitas m+N, Jadi tidak semua nitrit memiliki struktur ortorombik.
Nitrit organik
Nitrit organik, tidak seperti yang anorganik, bukan senyawa ionik tetapi kovalen. Karena itu mereka terbentuk dari molekul, yang ditandai dengan memiliki tautan r-aon, di mana R dapat menjadi kelompok alkil atau aromatik.
Mereka dianggap ester asam nitrat, karena hidrogen mereka, h-don, digantikan oleh kelompok R:
 Formula Umum untuk Nitrit Organik. Sumber: pngbot via wikipedia.
Formula Umum untuk Nitrit Organik. Sumber: pngbot via wikipedia. Menurut gambar superior, ester ini dapat ditulis sebagai rum = o, sangat mirip dengan rumus ester karbon, roc = o. Perhatikan kemiripan besar yang dimiliki struktur ini dengan senyawa nitro, rno2, dimana sekarang tautan utamanya adalah r-no2 dan bukan R-Dono. Oleh karena itu, satu -satunya perbedaan terletak pada atom yang bergabung dengannya2 ke grup r.
Karena alasan inilah ester nitrit dan senyawa nitro dianggap sebagai isomer penghubung, karena mereka memiliki atom yang sama, tetapi terkait secara berbeda.
Kompleks
Kompleks nitrit dapat memiliki komponen anorganik dan organik. Mereka membentuk hubungan koordinasi antara pusat logam dan salah satu oksigen tanpa2-. Artinya, tidak ada pembicaraan tentang interaksi murni elektrostatik, mN+TIDAK2-, tetapi koordinasi mN+-ATAU TIDAK-.
Dapat melayani Anda: apa sifat fisik materi?Nitrit organik dan kompleksnya akan membangun atau tidak struktur kristal tergantung pada apakah interaksi mereka berhasil mengatur partikel mereka di ruang angkasa.
Tata nama
Nitrit anorganik dan organik berbagi nomenklatur yang sangat sederhana. Untuk menamainya, kata -kata 'nitrite of', diikuti dengan nama logam dan valensi yang ditulis dalam tanda kurung ditempatkan terlebih dahulu. Demikian juga, ujungnya -co dan -jadi jika ada lebih dari satu valencia dapat digunakan.
Misalnya, cuno2 dapat dinamai dengan dua cara: tembaga nitrit (i), atau nitrit cuprous.
Aturan nomenklatur ini juga berlaku untuk nitrit organik. Misalnya, Cho3Ono disebut methilo nitrito, karena ch3 sesuai dengan grup R yang terhubung ke oksigen no2.
Nomenklatur dapat menjadi rumit jika ada kelompok lain yang memiliki relevansi kimia yang sama atau lebih besar dari NO2, atau jika mereka adalah kompleks logam.
Pelatihan
Nitrifikasi
Banyak nitrit anorganik terbentuk di alam dalam salah satu langkah siklus nitrogen: nitrifikasi. Proses ini terdiri dari oksidasi amonia yang dilakukan oleh mikroorganisme, khususnya, oleh bakteri nitrosomonas.
Nitrifikasi juga mencakup oksidasi nitrat selanjutnya menjadi nitrat; Namun, pembentukan nitrit adalah langkah lambat dari reaksi ini, karena membutuhkan energi yang lebih besar dan harus mengatasi penghalang kinetik yang lebih besar.
Persamaan berikut ini mencontohkan yang baru diekspos:
2nh4+ + 32 → 2no2- + 4H+ + 2h2SALAH SATU
Beberapa enzim berpartisipasi dalam reaksi ini dan hidroksilamin diproduksi, NH2Oh, yang merupakan produk dari mana anion nitrit akhirnya akan berasal.
Berkat nitrifikasi bahwa tanaman mengandung nitrit, dan pada gilirannya, hewan yang mengkonsumsinya. Nitrit tidak hanya ada di tanah, tetapi juga di laut, dan hampir semua produksi alami mereka disebabkan oleh aksi oksidatif dan anaerob dari berbagai mikroorganisme.
Nitrogen oksida dalam media dasar
Nitrit logam alkali dapat disiapkan secara industri dengan menggelembung nitrogen oksida dalam larutan dasar atau media, baik dari hidroksida atau karbonat masing -masing. Misalnya, nitium nitrit terjadi sesuai dengan reaksi berikut:
Tidak +tidak2 + NaOH → 2nano2 + H2SALAH SATU
Dalam kasus amonium nitrit, dyitrogen trioksida digelembungkan dalam amonia:
Dapat melayani Anda: rodio: sejarah, sifat, struktur, penggunaan, risiko2nh3 + H2Atau +n2SALAH SATU3 → 2nh4TIDAK2
Reaksi dengan oksida nitrat
Nitrit Alquilico, Rono, dapat disintesis dengan bereaksi. Reaksi umum akan menjadi sebagai berikut:
R-OH → R-Aon
Aplikasi Nitrit
Curing daging
 Warna daging kemerahan adalah karena obatnya dengan garam nitrat dan nitrat. Sumber: Pxhere.
Warna daging kemerahan adalah karena obatnya dengan garam nitrat dan nitrat. Sumber: Pxhere. Nitrit memiliki efek antibakteri, sehingga mereka ditambahkan dalam jumlah sedang untuk daging untuk memperlambat busuknya. Selain memenuhi fungsi ini, mereka bereaksi dengan protein daging untuk memberi mereka warna yang lebih kemerahan dan menarik.
Sisi buruk dari praktik ini adalah bahwa beberapa daging dapat memiliki terlalu banyak garam nitrit, dan saat memasaknya pada suhu tinggi, mereka berubah menjadi nitrosoaminas. Oleh karena itu, ada risiko meningkatkan kemungkinan tertular beberapa jenis kanker jika konsumsi daging yang disembuhkan ini berlebihan.
Pewarna batang
Nitrit digunakan dalam kimia organik untuk melakukan reaksi diazotasi, yang dengannya pewarna atau pewarna disintesis.
Pigmen
Beberapa kompleks nitrit, seperti kobalt, dapat digunakan sebagai pigmen untuk lukisan atau porselen karena warnanya yang mencolok.
Vasodilator
Nitrit bertanggung jawab untuk menghasilkan oksida nitrat dalam tubuh di daerah oksigen yang kurang. Dia bukan molekul pensinyalan, yang merespons pembuluh darah yang menenangkan dan memperluas. Ekspansi atau pelebaran ini sebagai konsekuensi bahwa tekanan darah berkurang.
Contoh nitrit
Akhirnya, beberapa contoh nitrit akan terdaftar dengan rumus dan nama masing -masing:
-Kakak2: Sodium nitrite
-Kno2: Kalium nitrit
-Mg (tidak2)2: Magnesium nitrit
-Menyemburkan2)2: kalsium nitrit
-Ch3Ch2Ono: etil nitrit
-NH4TIDAK2: amonium nitrit
-Zn (tidak2)2: seng nitrit
-PB (tidak2)2: Timbal nitrit (II) atau nitrit plumbose
-Iman (tidak2)3: Besi nitrit (iii) atau nitrit besi
-(Ch3)2Chch2Ch2Ono: isoamilo nitrito
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (Edisi ke -10.). Wiley Plus.
- Wikipedia. (2020). Nitrit. Diperoleh dari: di.Wikipedia.org
- Elsevier b.V. (2020). Nitrit. Ilmiah. Diperoleh dari: Scientedirect.com
- Alfa Aesar. (2020). Garam nitrit. Themo Fisher Scientific. Pulih dari: alfa.com
- Para editor Eeritlopaedia Britannica. (23 Februari 2018). Nitrit. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Anthony r. Butler & Martin Feelisch. (22 April 2018). Penggunaan terapi nitrit dan nitrat anorganik. doi.org/10.1161/Circulationaha.107.753814
- Kris Gunnars. (10 Februari 2020). Adalah nitrat dan nitrit dalam makanan yang berbahaya? Pulih dari: healthline.com
- « Teori perilaku sosial, jenis, norma, contoh
- Pembentukan senyawa biner, jenis, contoh, nomenklatur »

