Notasi spektral

- 615
- 69
- Dewey Runolfsdottir
 Tabel yang menunjukkan level dan orbital
Tabel yang menunjukkan level dan orbital Apa itu notasi spektral?
Itu Notasi spektral Ini adalah pengaturan elektron pada tingkat energi di sekitar inti atom. Menurut model atom lama Bohr, elektron menempati beberapa level dalam orbit di sekitar nukleus, dari lapisan pertama yang paling dekat dengan nukleus, k, ke lapisan ketujuh, Q, yang merupakan yang paling jauh dari nukleus.
Dalam hal model mekanik kuantum yang lebih halus, lapisan K-Q dibagi lagi menjadi satu set orbital, yang masing-masing dapat ditempati oleh tidak lebih dari beberapa elektron.
Umumnya, konfigurasi elektronik digunakan untuk menggambarkan orbital atom dalam keadaan fundamentalnya, tetapi juga dapat digunakan untuk mewakili atom yang telah terionisasi dalam kation atau anion, mengkompensasi dengan kehilangan atau keuntungan elektron di orbital masing -masing.
Banyak sifat fisik dan kimia elemen dapat dikorelasikan dengan konfigurasi elektronik yang unik. Elektron Valencia, elektron di lapisan terluar, adalah faktor penentu untuk kimia unik dari elemen.
Saat elektron dari lapisan terluar atom menerima energi dari beberapa jenis, mereka pindah ke lapisan energi yang lebih besar. Dengan demikian, elektron di lapisan K akan ditransfer ke lapisan L yang berada dalam keadaan energi terbesar.
Ketika elektron kembali ke keadaan fundamentalnya, ia melepaskan energi yang diserap dengan memancarkan spektrum elektromagnetik (cahaya). Karena setiap atom memiliki konfigurasi elektronik tertentu, ia juga akan memiliki spektrum spesifik yang akan disebut spektrum penyerapan (atau emisi).
Untuk alasan ini, notasi istilah spektral digunakan untuk merujuk pada konfigurasi elektronik.
Bagaimana menentukan notasi spektral: angka kuantum
Sebanyak empat angka kuantum digunakan untuk sepenuhnya menggambarkan gerakan dan lintasan setiap elektron di dalam atom.
Kombinasi semua jumlah kuantum semua elektron dalam atom dijelaskan oleh fungsi gelombang yang memenuhi persamaan Schrödinger. Setiap elektron dalam atom memiliki set kuantum yang unik.
Itu dapat melayani Anda: fraksi molar: bagaimana itu dihitung, contoh, latihanMenurut prinsip pengecualian Pauli, dua elektron tidak dapat berbagi kombinasi yang sama dari empat angka kuantum.
Angka kuantum penting karena dapat digunakan untuk menentukan konfigurasi elektronik atom dan kemungkinan lokasi elektron atom.
Angka kuantum juga digunakan untuk menentukan karakteristik atom lainnya, seperti energi ionisasi dan jari -jari atom.
Angka kuantum menunjuk shell spesifik, subkap, orbital dan elektron belokan.
Ini berarti bahwa mereka sepenuhnya menggambarkan karakteristik elektron dalam atom, yaitu, mereka menggambarkan setiap solusi tunggal untuk persamaan Schrödinger, atau fungsi gelombang, elektron dalam atom.
Ada total empat angka kuantum: Angka kuantum utama (N), jumlah kuantum sudut orbital (L), angka kuantum magnetik (mL) dan jumlah kuantum spin elektron (MS).
Angka kuantum utama, NN, menggambarkan energi elektron dan jarak yang paling mungkin dari elektron inti. Dengan kata lain, ini mengacu pada ukuran orbital dan tingkat energi di mana elektron ditempatkan.
Jumlah subkap, atau LL, menggambarkan bentuk orbital. Itu juga dapat digunakan untuk menentukan jumlah node sudut.
Angka kuantum magnetik, ML, menggambarkan tingkat energi dalam subkap, dan lebih banyak mengacu pada putaran pada elektron, yang bisa naik atau turun.
Prinsip Aufbau
Aufbau berasal dari kata Jerman Aufbauen, Apa arti "membangun". Intinya, saat menulis konfigurasi elektron kami membangun orbital elektron saat kami maju dari satu atom ke atom lainnya.
Saat kami menulis konfigurasi elektronik atom, kami akan mengisi orbital dalam meningkatkan urutan nomor atom.
Prinsip Aufbau berasal dari prinsip pengecualian Pauli, yang mengatakan tidak ada dua fermion (misalnya, elektron) dalam atom.
Itu dapat melayani Anda: asam butirat: formula, sifat, risiko dan penggunaanMereka dapat memiliki set kuantum yang sama, jadi mereka harus "menumpuk" pada tingkat energi yang lebih tinggi. Bagaimana elektron menumpuk adalah topik pengaturan elektron.
Atom -atom stabil memiliki elektron sebanyak yang dilakukan proton di dalam nukleus. Elektron berkumpul di sekitar nukleus dalam orbital kuantum mengikuti empat aturan dasar yang disebut prinsip aufbau.
1. Tidak ada dua elektron dalam atom yang berbagi empat angka kuantum yang sama n, l, m, dan s.
2. Elektron pertama -tama akan menempati orbital tingkat energi terendah.
3. Elektron akan mengisi orbital selalu dengan nomor putaran yang sama. Saat orbital penuh, itu akan dimulai.
4. Elektron akan mengisi orbital untuk jumlah angka kuantum n dan l. Orbital dengan nilai yang sama (n + l) akan diisi terlebih dahulu dengan nilai N yang lebih rendah.
Aturan kedua dan keempat pada dasarnya sama. Contoh aturan empat adalah orbital 2p dan 3s.
Orbital 2p adalah n = 2 dan l = 2 dan orbital 3s adalah n = 3 dan l = 1. (N + l) = 4 dalam kedua kasus, tetapi orbital 2p memiliki energi terendah atau nilai yang lebih rendah dan akan diisi sebelum lapisan 3s.
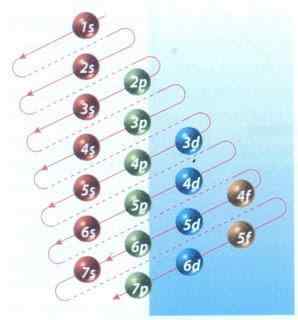 Gambar 2: Diagram Moeller dari pengisian konfigurasi elektronik
Gambar 2: Diagram Moeller dari pengisian konfigurasi elektronik Untungnya, Anda dapat menggunakan diagram Moeller yang ditunjukkan pada Gambar 2 untuk mengisi elektron. Grafik dibaca dengan mengeksekusi diagonal dari 1s.
Gambar 2 menunjukkan orbital atom dan panah menunjukkan cara untuk mengikuti.
Sekarang diketahui bahwa urutan orbital diisi, satu -satunya hal yang tersisa adalah menghafal ukuran masing -masing orbital.
Orbital memiliki 1 kemungkinan nilai ml Mengandung 2 elektron
Orbital p memiliki 3 kemungkinan nilai ml Mengandung 6 elektron
Orbital memiliki 5 nilai yang mungkin dari ml Mengandung 10 elektron
F orbital memiliki 7 kemungkinan nilail Mengandung 14 elektron
Hanya ini yang diperlukan untuk menentukan konfigurasi elektronik atom elemen yang stabil.
Dapat melayani Anda: dodecil natrium sulfate (SDS): struktur, sifat, penggunaanMisalnya, ambil elemen nitrogen. Nitrogen memiliki tujuh proton dan, oleh karena itu, tujuh elektron. Orbital pertama untuk diisi adalah orbital 1s. Orbital S memiliki dua elektron, jadi ada lima elektron yang tersisa.
Orbital berikutnya adalah orbital 2S dan berisi dua berikutnya. Tiga elektron terakhir akan masuk ke orbital 2p yang dapat mengandung hingga enam elektron.
Aturan wastafel
Bagian Aufbau membahas bagaimana elektron mengisi orbital energi terendah terlebih dahulu dan kemudian pindah ke orbital energi tertinggi hanya setelah orbital energi yang lebih rendah penuh.
Namun, ada masalah dengan aturan ini. Tentu saja, orbital 1S harus diisi sebelum orbital 2s, karena orbital 1S memiliki nilai n yang lebih rendah, dan, oleh karena itu, energi yang lebih rendah.
Dan tiga orbital yang berbeda? Dalam urutan mana mereka harus diisi? Jawaban atas pertanyaan ini melibatkan aturan wastafel.
Aturan wastafel menetapkan itu:
- Setiap orbital dalam sub -tingkat ditempati secara individual sebelum orbital apa pun ditempati dua kali lipat.
- Semua elektron dalam orbital yang ditempati secara individual memiliki belokan yang sama (untuk memaksimalkan total belokan).
Ketika elektron ditugaskan ke orbital, elektron pertama -tama berupaya mengisi semua orbital dengan energi yang sama (juga disebut orbital degenerasi) sebelum dicocokkan dengan elektron lain dalam orbital setengah -penuh.
Atom -atom di negara -negara bumi cenderung memiliki sebanyak mungkin elektron yang tidak dibuat -buat. Saat memvisualisasikan proses ini, pertimbangkan bagaimana elektron menunjukkan perilaku yang sama dengan kutub yang sama dalam magnet jika mereka akan menghubungi.
Ketika elektron yang bermuatan negatif mengisi orbital, pertama -tama mereka mencoba untuk pergi sebanyak mungkin sebelum harus mencocokkan.
Referensi
- Angka kuantum. Kimia pulih.Librettexts.org.
- Konfigurasi elektron dan sifat atom (s.F.). Pulih dari Oneonta.Edu.
- Konfigurasi elektronik. Pulih dari Britannica.com.

