Orbital yang mengalami kemunduran

- 953
- 126
- Dewey Runolfsdottir
 Skema energi dengan orbital yang ditempati oleh elektron yang hilang. Sumber: Gabriel Bolívar
Skema energi dengan orbital yang ditempati oleh elektron yang hilang. Sumber: Gabriel Bolívar Itu Orbital yang mengalami kemunduran Mereka adalah yang ditemukan pada tingkat energi yang sama. Menurut definisi ini, mereka harus memiliki angka kuantum utama yang sama N. Dengan demikian, orbital 2S dan 2P didegenerkan, karena mereka termasuk tingkat energi 2, meskipun diketahui bahwa fungsi gelombang sudut dan radial berbeda.
Sebagai nilai dari N, Elektron mulai menempati sub -level energi lainnya, seperti orbital D dan F.
Masing -masing orbital ini memiliki karakteristik sendiri, yang pada pandangan pertama diamati dalam bentuk sudut mereka; Ini adalah figur bola (s), dumbbell (p), daun semanggi (d) dan globular (f).
Di antara mereka ada perbedaan energi, bahkan milik tingkat yang sama N.
Misalnya, skema energi dengan orbital yang ditempati oleh elektron yang hilang (kasus abnormal) ditunjukkan pada gambar atas (kasus abnormal).
Dapat dilihat bahwa dari semua, yang paling stabil (energi terkecil) adalah orbital NS (1s, 2s, ...), sedangkan NF adalah yang paling tidak stabil (yang dengan energi terbesar).
Orbital yang mengalami degenerasi dari atom yang terisolasi
Orbital yang mengalami degenerasi, dengan nilai yang sama seperti N, Mereka berada di garis yang sama dalam skema energi.
Untuk alasan ini, tiga garis merah yang melambangkan orbital P terletak di garis yang sama; seperti dengan cara yang sama seperti garis ungu dan kuning.
Skema gambar melanggar aturan wastafel: orbital energi yang lebih besar diisi dengan elektron.
Dapat melayani Anda: asam dan basa: perbedaan, karakteristik, contohSaat elektron kawin, orbital kehilangan energi, dan memberikan tolakan elektrostatik yang lebih besar pada elektron yang hilang dari orbital lainnya.
Namun, efek seperti itu tidak dipertimbangkan dalam banyak diagram energi. Jika demikian, dan mematuhi aturan wastafel tanpa sepenuhnya mengisi orbital D, akan terlihat bahwa mereka berhenti merosot.
Seperti yang dinyatakan di atas, setiap orbital memiliki karakteristiknya sendiri. Atom yang terisolasi, dengan konfigurasi elektroniknya, bersedia elektronnya dalam jumlah orbital yang tepat yang memungkinkan mereka meng -host mereka.
Hanya mereka yang dalam energi yang dapat dianggap sebagai degenerasi.
Orbital p
Tiga garis merah untuk orbital gambar gambar menunjukkan bahwa keduanya pX, PDan Dan pz Mereka memiliki energi yang sama.
Ada elektron yang menghilang di masing -masing, dijelaskan oleh empat angka kuantum (N, l, ml Dan MS), sementara tiga yang pertama menggambarkan orbital.
Satu -satunya perbedaan di antara mereka dilambangkan dengan momen magnetik ml, yang menarik lintasan pX Pada sumbu x, pDan pada sumbu y, dan pz pada sumbu z.
Ketiganya sama, tetapi mereka hanya berbeda dalam orientasi spasial mereka. Karena alasan ini mereka selalu tertarik pada energi, yaitu, merosot.
Seperti yang sama, atom nitrogen inomotif (dengan konfigurasi 1S22s22 p3) Anda harus menjaga ketiga orbital Anda. Namun, skenario energi berubah secara tiba -tiba jika dianggap sebagai atom N dalam molekul atau senyawa kimia.
Itu demikian karena meskipun pX, PDan Dan pz Mereka sama dalam energi, ini dapat bervariasi di masing -masing jika mereka memiliki lingkungan kimia yang berbeda; yaitu, jika mereka terkait dengan atom yang berbeda.
Dapat melayani Anda: isopreno: struktur, sifat, aplikasiOrbital d
Lima garis ungu menunjukkan orbital D. Dalam atom yang terisolasi, bahkan jika mereka memiliki elektron berpasangan, mereka dianggap bahwa kelima orbital ini merosot. Namun, tidak seperti orbital P, kali ini ada perbedaan yang nyata dalam bentuk sudutnya.
Oleh karena itu, elektron mereka melakukan arah perjalanan di ruang yang bervariasi dari satu orbital D ke yang lain.
Ini menyebabkan, menurut Teori medan kristal, bahwa gangguan minimal menyebabkan a energi yang sedang berlangsung orbital; Artinya, lima garis ungu terpisah meninggalkan celah energi di antara mereka:
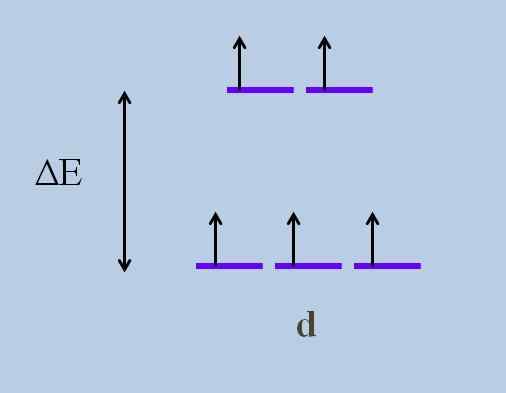 Skema orbital yang sedang berlangsung. Sumber: Gabriel Bolívar
Skema orbital yang sedang berlangsung. Sumber: Gabriel Bolívar Apa saja orbital di atas dan yang di bawah ini? Yang di atas dilambangkan sebagai DanG, dan yang di bawah ini T2 g.
Perhatikan bagaimana awalnya semua garis ungu disejajarkan, dan sekarang satu set dua orbital terbentuk DanG lebih banyak energi daripada set tiga orbital lainnya T2 g.
Teori ini memungkinkan untuk menjelaskan transisi D-D, di mana banyak warna yang diamati dalam senyawa logam transisi (CR, MN, Faith, dll.).
Gangguan elektronik ini disebabkan oleh interaksi koordinasi pusat logam dengan molekul lain yang disebut Ligan.
Orbital f
Dan dengan orbital f, tujuh garis kuning, situasinya lebih rumit. Alamat spasialnya sangat bervariasi di antara mereka, dan visualisasi tautan mereka menjadi terlalu rumit.
Faktanya, dianggap bahwa orbital f adalah lapisan internal sedemikian rupa sehingga mereka tidak "berpartisipasi cukup" dalam pembentukan tautan.
Itu dapat melayani Anda: oksida perklorik (cl2o7)Ketika atom yang diisolasi dengan orbital F dikelilingi oleh atom lain, interaksi dimulai dan terjadi terjadi (hilangnya degenerasi):
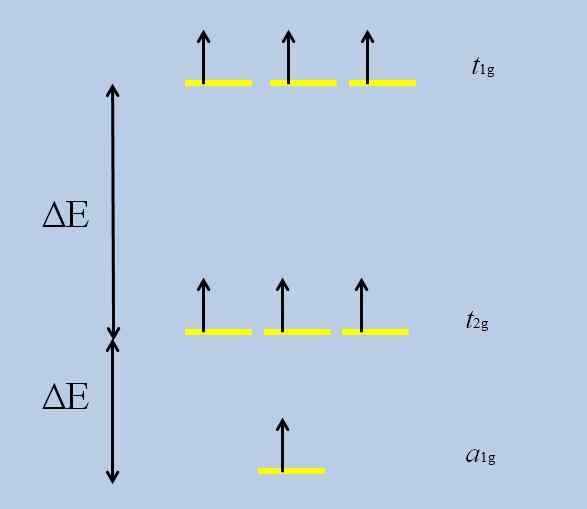 Skema Kehilangan Degenerasi. Sumber: Gabriel Bolívar
Skema Kehilangan Degenerasi. Sumber: Gabriel Bolívar Perhatikan bahwa sekarang garis -garis kuning membentuk tiga set: T1g, T2 g Dan ke1g, Dan mereka tidak lagi mengalami kemunduran.
Orbital hibrida yang mengalami degenerasi
Telah terlihat bahwa orbital bisa terungkap dan kehilangan degenerasi. Namun, meskipun ini menjelaskan transisi elektronik, itu tidak mengklarifikasi bagaimana dan mengapa ada geometri molekul yang berbeda. Di sini orbital hibrida masuk.
Karakteristik utamanya adalah mereka mengalami kemerosikan. Dengan demikian, mereka muncul dari campuran karakter orbital s, p, d dan f, untuk menyebabkan hibrida yang merosot.
Misalnya, tiga orbital P dicampur dengan satu S untuk memberikan empat orbital sp3. Semua orbital SP3 Mereka mengalami kemunduran, dan karenanya memiliki energi yang sama.
Jika juga dua orbital dicampur dengan empat SP3, Enam orbital akan diperoleh3D2.
Dan bagaimana geometri molekuler menjelaskan? Karena ada enam, dengan energi yang sama, mereka harus dipandu secara simetris di ruang untuk menghasilkan lingkungan kimia yang sama (misalnya, dalam senyawa MF6).
Ketika mereka melakukannya, oktahedron koordinasi terbentuk, yang sama dengan geometri oktahedral di sekitar pusat (m).
Namun, geometri biasanya menghadirkan distorsi, yang berarti bahwa bahkan orbital hibrida tidak sepenuhnya merosot.
Oleh karena itu, sebagai kesimpulan, orbital yang merosot hanya ada dalam atom yang terisolasi atau lingkungan yang sangat simetris.
Referensi
- Definisi Degerate. Pulih dari: chemicool.com
- Atom dan orbital atom. Pulih dari sparknotes.com
- Whitten, Davis, Peck & Stanley. Kimia. (8.ª ed.). Pembelajaran Cengage.

