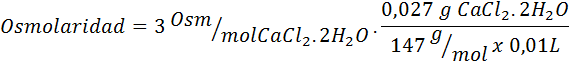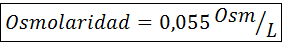Osmolaritas
- 2188
- 579
- Joseph Nader PhD
Apa itu osmolaritas?
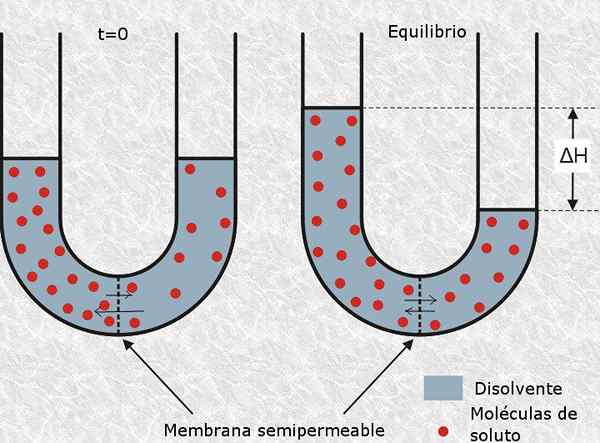
Itu Osmolaritas Ini adalah unit konsentrasi yang menunjukkan konsentrasi molar dari set partikel aktif osmotik yang ada dalam larutan. Dengan kata lain, osmolaritas adalah molaritas partikel aktif osmotik.
didefinisikan sebagai partikel aktif osmotik untuk molekul netral atau ion yang tidak dapat melintasi membran semipermeabel, seperti membran sel. Kehadiran jenis partikel ini menghasilkan tekanan osmotik dalam larutan, dan karenanya namanya.
Jumlah mol partikel aktif osmotik disebut Osmoles (diwakili oleh simbol OSM), jadi osmolaritas diekspresikan dalam satuan OSM/L.
Pentingnya Osmolaritas
Osmolaritas adalah konsep yang sangat penting bagi biologi dan kedokteran, karena keseimbangan osmotik sel dengan lingkungan mereka sangat penting untuk kelangsungan hidup mereka. Misalnya, menyuntikkan solusi dengan osmolaritas yang sangat tinggi atau sangat rendah secara intravena, dapat dengan mudah menyebabkan kematian pada pasien.
 Osmolaritas adalah aspek penting dari solusi dalam kedokteran dan biologi
Osmolaritas adalah aspek penting dari solusi dalam kedokteran dan biologi Di sisi lain, teknik yang sangat umum yang digunakan ahli biologi sel untuk memecahkan sel dari berbagai jenis adalah melalui lisis osmotik. Ini terdiri dari menempatkan sel dalam larutan hipotonik (dengan osmolaritas yang sangat rendah) sehingga air larutan menembusnya dengan osmosis dan meledaknya.
Ini membuatnya sangat penting, baik untuk dokter maupun untuk ahli biologi dan profesional dari daerah lain, mengetahui, mengukur atau mengetahui cara menghitung osmolaritas suatu solusi.
Dapat melayani Anda: konsentrasi persentasePerbedaan antara osmolaritas dan osmolalitas
Saat berbicara tentang osmolaritas, juga perlu untuk berbicara tentang osmolality. Osmolalitas mirip dengan osmolaritas, dengan cara yang sama moralitasnya mirip dengan molaritas.
Sedangkan osmolaritas menunjukkan Jumlah Osmole per liter solusi (OSM/L), Osmolality menunjukkan hal yang sama, tetapi Untuk setiap kilogram pelarut (OSM/kg).
Osmolality memiliki keuntungan bahwa, tidak tergantung pada volume larutan, juga tidak bergantung pada kepadatan atau suhu. Untuk alasan ini, solusi akan memiliki osmolalitas yang sama pada 25 ° C seperti pada suhu 37 ° C. Di sisi lain, osmolaritas 37 ° C akan sedikit lebih rendah dari osmolaritasnya pada 25 ° C, karena peningkatan volume ekspansi termal.
Osmolarisitas biasanya lebih mudah diukur secara eksperimental daripada osmolaritas. Namun, osmolaritas lebih mudah dihitung dan merupakan unit yang lebih mudah untuk bekerja saat pengenceran disiapkan.
Bagaimana osmolaritas larutan dihitung?
Ada beberapa cara untuk menghitung osmolaritas solusi, tergantung pada informasi yang dihitung. Itu dapat dihitung dari:
- Jumlah zat terlarut dan solusi.
- Molaritas zat terlarut hadir.
- Konsentrasi ion individu.
- Persentase m/v dari zat terlarut, antara lain.
Dalam semua kasus, perhitungan didasarkan pada rumus umum osmolaritas, yaitu:

Di mana NOSM Itu adalah jumlah osmol yang ada dalam solusi dan Vmatahari Itu adalah volume yang sama yang diungkapkan dalam liter. Jumlah Osmol dihitung dengan mengalikan jumlah mol dalam zat terlarut dengan jumlah partikel di mana ia terdisosiasi dalam larutan.
Dapat melayani Anda: campuran heterogen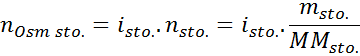
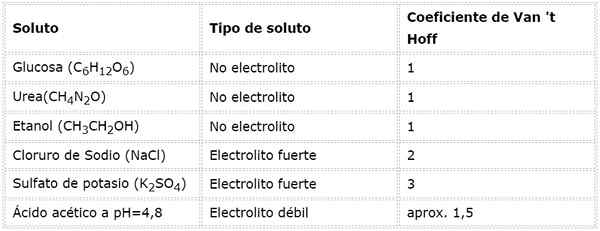
Dalam persamaan ini, NSto Itu adalah jumlah mol zat terlarut, MSto adalah massanya (dalam g), MmSto Itu adalah massa molar (dalam g/mol) dan yoSto Itu adalah koefisien van 't hoff dari zat terlarut. Koefisien ini memiliki nilai dari 1 untuk zat terlarut non -elektrolit (Seperti glukosa, misalnya).
Untuk elektrolit kuat yang sepenuhnya terdisosiasi (seperti natrium klorida, NaCl) koefisien van 't hoff sama dengan jumlah total ion di mana setiap mol senyawa terdisosiasi.
Misalnya, dalam kasus kalium sulfat, k2Sw4, yang reaksi disosiasi siapa:
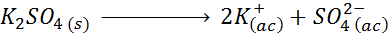
Setiap mol garam yang larut menghasilkan 3 mol ion (ion 2 K+ Dan 1 jadi ion42-), karena itu I = n = 3.
Dalam kasus elektrolit yang lemah, perhitungannya lebih rumit, tetapi biasanya ditentukan secara eksperimental. Tabel berikut merangkum koefisien van 't hoff untuk beberapa zat terlarut umum.
Contoh Perhitungan Osmolaritas
1. Contoh 1
Tentukan osmolaritas larutan yang disiapkan dengan melarutkan 10 g NaCl dan 10 g glukosa dalam 100 mL larutan
Larutan: Dalam hal ini, osmol setiap zat terlarut dihitung secara terpisah dan kemudian tambahkan. Massa molar masing -masing adalah 58,45 g/mol dan 180 g/mol, dan koefisien ve 't hoff adalah 2 dan 1:
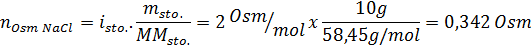
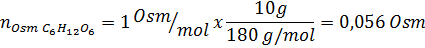
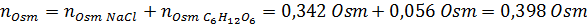
Sekarang kami menghitung osmolaritas menggunakan rumus, mengetahui bahwa 100 mL sama dengan 0,100L:
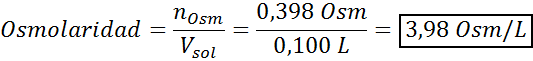
Akhirnya, osmolaritas solusinya adalah 3,98 OSM/L.
2. Contoh 2
Tentukan osmolaritas larutan 0,05 molar kalium sulfat.
Larutan: Jika kita sudah mengetahui molaritas zat terlarut, menghitung osmolaritas sesederhana mengalikan konsentrasi ini dengan faktor van 't hoff.
Dapat melayani Anda: benzaldehyde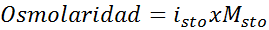
Dalam hal ini, faktor garam adalah 3.
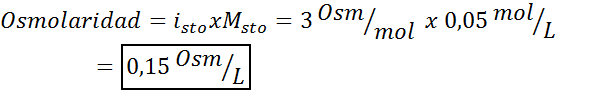
3. Contoh 3
Tentukan osmolaritas sampel plasma yang mengandung ion natrium 0,125 M, ion kalium 0,020 m dan ion 0,145 klorida.
Larutan: Osmolaritas ion individu sama dengan molaritasnya, karena ion tidak memisahkan lebih banyak dan memiliki a I = 1. Karena alasan ini, dalam hal ini hanya perlu dikalikan dengan i = 1 Setiap konsentrasi dan tambahkan:
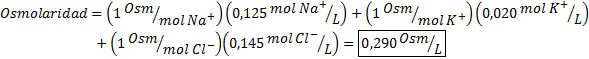
4. Contoh 4
Hitung osmolaritas larutan yang mengandung 27 mg CAP2.2h2Atau untuk setiap 10 ml solusi
Larutan: Berat molekul cochl2.2h2Atau 147 g/mol. Saat larut, garam ini dipisahkan menjadi 2 molekul air dan tiga ion. Namun, molekul air bukan partikel aktif osmotik sehingga tidak diperhitungkan untuk perhitungan osmolaritas, dan koefisien untuk senyawa ini adalah 3.

5. Contoh 5
Massa natrium klorida apa yang diperlukan untuk menyiapkan 3 liter larutan yang osmolaritasnya adalah 1,20 OSM/L?
Larutan: Dalam hal ini, karena massa zat terlarut diminta dan kami memiliki volume dan konsentrasi, itu cukup untuk membersihkan massa formula osmolaritas.