Struktur Sodium Oxalate (Na2C2O4), Sifat, Penggunaan, Risiko

- 1911
- 390
- Pete Lesch
Dia Sodium oksalat Ini adalah senyawa organik yang dibentuk oleh dua ion natrium dan ion oksalat. Formula kimianya adalah na2C2SALAH SATU4 atau juga na2(MENDEKUT)2. Itu adalah garam natrium asam oksalat atau asam etanodioat. Na2C2SALAH SATU4 Ini adalah padatan putih kristal dan solusi berairnya adalah dasar (basa).
Sodium oksalat hadir dalam tanaman dan sayuran. Dalam manusia, dihasilkan secara alami dari asam oksalat asam terkonjugasi, yang pada gilirannya dihasilkan oleh proses metabolisme tertentu.
 Sodium oksalat NA2(MENDEKUT)2 padat. Lem [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Sodium oksalat NA2(MENDEKUT)2 padat. Lem [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Na2C2SALAH SATU4 Ini digunakan dalam laboratorium analisis kimia sebagai zat pereduksi (kebalikan dari oksidan). Juga untuk memungkinkan tes ke senyawa organik tertentu selama pengolahan air limbah.
Ini telah digunakan untuk eliminasi limbah klorofluorokarbon (CGC), yang merusak lapisan ozon. Itu juga bahan baku untuk mendapatkan asam oksalat dengan cara yang ekonomis.
Karena kandungan natrium oksalat yang tinggi dari beberapa sayuran yang dapat dimakan, orang yang memiliki kecenderungan untuk membentuk perhitungan atau batu ginjal harus menghindari mengonsumsi makanan seperti itu. Ini karena batu -batu itu umumnya dibentuk dengan oksalat.
[TOC]
Struktur
Sodium oksalat terdiri dari dua kation natrium+ dan anion oksalat (COO)22-. Anion oksalat terbentuk pada gilirannya oleh dua COO- Bergabung melalui dua atom karbon: -OOC-COO-.
Dalam natrium oksalat padat, anion oksalat memiliki bentuk datar. Ini berarti bahwa karbon dan oksigen ditemukan di bidang yang sama.
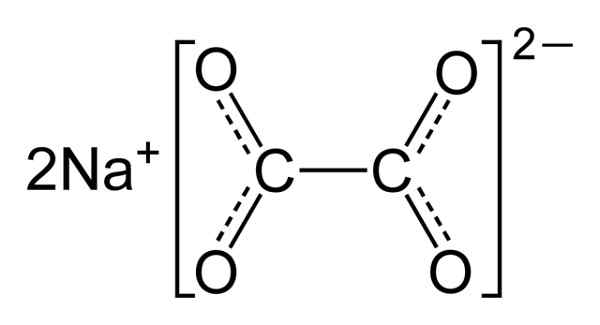 Struktur kimia natrium oksalat2(MENDEKUT)2. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons.
Struktur kimia natrium oksalat2(MENDEKUT)2. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons. Tata nama
- Sodium oksalat
- Dysodio oksalat
- Garam natrium asam etanodioat
Properti
Keadaan fisik
Solid putih kristal.
Berat molekul
134.0 g/mol
Kepadatan
2.27 g/cm3 pada 20 ° C.
Kelarutan
Soluble Air: 3,7 g/100 ml pada 20 ° C.
ph
Solusi berairnya adalah dasar (basa) karena anion oksalat cenderung mengambil proton air yang meninggalkan ion oh bebas-.
Dapat melayani Anda: neon: sejarah, sifat, struktur, risiko, penggunaanSifat kimia
Itu dapat menetralkan asam dan reaksi adalah eksotermik, yaitu, mereka mengeluarkan panas.
Itu berfungsi sebagai agen pereduksi dan dalam reaksi ini menghasilkan karbon dioksida Co2.
Ini memiliki sifat bergabung dengan beberapa ion logam seperti iman ion besi besi2+ dan iman besi3+.
Memperoleh
Menurut sumber yang dikonsultasikan, natrium oksalat dapat diperoleh oksigen oksidasi atau2 Pada suhu sekitar 250 ° C dalam larutan terkonsentrasi naOH natrium hidroksida.
Kehadiran di alam
Sodium oksalat hadir di banyak tanaman dan sayuran, seperti chard, bayam dan ruibarbo, dan biji -bijian seperti kedelai, di antara banyak produk tanaman lainnya.
 Bayam memiliki banyak natrium oksalat. Penulis: Aline Ponce. Sumber: Pixabay.
Bayam memiliki banyak natrium oksalat. Penulis: Aline Ponce. Sumber: Pixabay. Asam oksalat asam terkonjugasi terjadi pada organisme manusia oleh metabolisme asam glikolat atau asam askorbat. Setelah diproduksi itu tidak dimetabolisme, tetapi diekskresikan oleh urin berbentuk oksalat.
 Ruibarbo mengandung natrium oksalat. Penulis: s. Hermann & F. Richter. Sumber: Pixabay.
Ruibarbo mengandung natrium oksalat. Penulis: s. Hermann & F. Richter. Sumber: Pixabay. Aplikasi
Di laboratorium analisis kimia
Ini digunakan sebagai reagen kimia, biasanya sebagai zat pereduksi, misalnya untuk standardisasi solusi kalium permanganat, yaitu, untuk menentukan dengan tepat berapa banyak natrium permanganat yang mereka miliki.
Dalam penghancuran klorofluorokarbon
Sodium oksalat telah digunakan untuk penghancuran klorofluorokarbon (CFC). Senyawa CFC ini telah menjadi salah satu dari mereka yang bertanggung jawab atas penghancuran lapisan ozon planet (yang melindungi kita dari radiasi ultraviolet).
Pada tahun 1996, beberapa peneliti mengusulkan penggunaan natrium oksalat untuk menghilangkannya, karena mudah bereaksi dengan CFC pada suhu 270-290 ° C, menjadikannya produk yang tidak berbahaya ke arah lapisan ozon.
Reaksi natrium oksalat dengan CFC dapat dikontrol untuk mendapatkan hidrokarbon aromatik terhalogenasi yang tidak berbahaya bagi lapisan ozon tetapi merupakan senyawa yang berguna dalam industri kimia.
Itu dapat melayani Anda: propilen glikol: struktur, sifat, sintesis dan penggunaanReaksi ini juga dapat dibawa ke maksimum dan mengubah seluruh CFC menjadi NAF natrium fluorida, natrium klorida Soll, karbon dasar dan karbon dioksida CO2.
 Lapisan ozon planet melindungi kita dari sinar ultraviolet matahari. Sodium oksalat memungkinkan Anda untuk menghilangkan senyawa CFC yang merusaknya. Penulis: One94. Sumber: Pixabay.
Lapisan ozon planet melindungi kita dari sinar ultraviolet matahari. Sodium oksalat memungkinkan Anda untuk menghilangkan senyawa CFC yang merusaknya. Penulis: One94. Sumber: Pixabay. Dalam menentukan parameter penting dalam pengolahan air limbah
Telah ditemukan bahwa natrium oksalat berguna untuk mengukur kuantitas dan kelas senyawa organik yang mengeluarkan mikroorganisme lumpur yang digunakan untuk mengolah air limbah.
Ukuran senyawa tersebut penting untuk menentukan fungsinya selama pengolahan air limbah, karena kemudahan memisahkan lumpur dari air tergantung pada mereka.
Menggunakan natrium oksalat, ketidaknyamanan metode lain dihindari.
Untuk mendapatkan asam oksalat
Sodium oksalat mentah dari limbah dari proses tertentu telah digunakan untuk menghasilkan asam oksalat H2C2SALAH SATU4 dalam jumlah besar.
Metode ini menggunakan lumpur dari proses Bayer untuk mengobati bauksit (mineral aluminium). Dalam proses Bayer, bauksit diperlakukan dengan naoh natrium hidroksida untuk melarutkan alumina mineral ini.
Dalam proses melarutkan alumina, senyawa organik tertentu yang ada dalam mineral seperti asam humat diserang oleh NaOH, menghasilkan sejumlah besar natrium oksalat NA2C2SALAH SATU4.
Sodium oksalat ini dimasukkan ke dalam lumpur dengan senyawa aluminium. Untuk memurnikannya, rakitan dilarutkan, disaring dan melewati kolom pertukaran ion tipe asam.
Di kolom ada resin asam sulfonat RSO3H di mana ion logam na dipertukarkan+ oleh ion hidrogen h+, Jadi Anda mendapatkan asam oksalat h2C2SALAH SATU4.
Rso3H + na2C2SALAH SATU4 ⇔ rso3Na + Nahc2SALAH SATU4
Dapat melayani Anda: kalium karbonat (k2co3): struktur, sifat, penggunaan, mendapatkanRso3H + nahc2SALAH SATU4 ⇔ rso3Na + h2C2SALAH SATU4
Ini adalah proses ekonomi dan asam oksalat yang diperoleh adalah kemurnian yang dapat diterima.
Untuk menghilangkan senyawa yang tidak diinginkan
Asam natrium oksalat terkonjugasi, asam oksalat H2C2SALAH SATU4, Itu digunakan untuk melarutkan jenis limbah dan inlay tertentu.
Karakteristik asam oksalat dari menjadi oksalat digunakan bertindak sebagai zat kompleks atau endapan misalnya selama pemrosesan limbah dari berbagai bahan bakar nuklir.
Asam oksalat juga digunakan untuk menghilangkan inlay mineral dan oksida besi dalam pipa dan peralatan lainnya, ini karena kemampuannya untuk sangat bergabung dengan iman ion besi2+ Sebagai iman ion besi3+ membentuk oksalat.
Risiko
Jika natrium oksalat dihirup atau dicerna secara langsung. Ini menghasilkan muntah, pembersihan parah, denyut nadi lemah, keruntuhan kardiovaskular, gejala neuromuskuler dan kerusakan ginjal.
Orang yang memiliki kecenderungan untuk membentuk perhitungan di ginjal karena akumulasi oksalat dalam urin harus menghindari mengonsumsi sayuran dengan kandungan oksalat terlarut yang tinggi seperti natrium.
Natrium oksalat dalam jumlah tinggi dalam makanan saat mencapai urin berikatan dengan kalsium yang ada dalam hal ini dan dapat menghasilkan perhitungan atau batu kalsium oksalat di ginjal kepada orang yang memiliki kecenderungan untuk melakukannya.
 Sodium oksalat dari beberapa makanan dapat menyebabkan pembentukan batu di ginjal orang dengan kecenderungannya. Penulis: Azwer. Sumber: Pixabay.
Sodium oksalat dari beberapa makanan dapat menyebabkan pembentukan batu di ginjal orang dengan kecenderungannya. Penulis: Azwer. Sumber: Pixabay. Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Sodium oksalat. Pusat Nasional Informasi Bioteknologi. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Chai, w. Dan Liebman, m. (2005). Pengaruh metode memasak yang berbeda pada kandungan oksalat sayuran. J. Agric. Makanan makanan. 2005, 53, 3027-3030. Pulih dari pub.ACS.org.
- Dagani, r. (seribu sembilan ratus sembilan puluh enam). CFC menghancurkan Reion. Arsip Berita Kimia & Teknik 1996, 74, 4, 6-7. Pulih dari pub.ACS.org.
- Sajad, m. dan Kim, k.S. (2016). Ekstraksi zat polimer ekstraseluler dari lumpur aktif menggunakan natrium oksalat. Int. J. Lingkungan. Sci. Technol. 13, 1697-1706 (2016). Tautan pulih.Peloncat.com.
- Jeffrey, g.KE. Dan Parry, G.S. (1954). Struktur kristal natrium oksalat. J. SAYA. Chem. Soc. 1954, 76, 21, 5283-5286. Pulih dari pub.ACS.org.
- Okuwaki, a. et al. (1984). Produksi oksalat oleh oksidasi batubara dengan oksigen dalam larutan natrium hidroksida terkonsentrasi. Ind. Eng. Chem. Melecut. Daging sapi. Dev. 1984, 23, 648-651. Pulih dari pub.ACS.org.
- Hefter, g. et al. (2018). Kelarusan natrium oksalat dalam larutan elektrolit pekat. J Chem & ENG Data. 2018, 63, 3, 542-552. Pulih dari pub.ACS.org.
- La k. yo. (1992). Proses untuk persiapan asam oksalat dan natrium hidrogen oksalat dari natrium oksalat mentah. ATAU.S. Paten No. 5.171.887. Dec.15, 1992. Diperoleh dari FreepatentsSoneLine.com.
- « Haptes History, Fungsi, Karakteristik, Jawaban Inmunes
- Struktur natrium tripoliphosphate (na5p3o10), sifat, penggunaan, dampak »

