Struktur, fungsi dan jenis peroksidase
- 4645
- 737
- Ray Thiel
Itu Peroksidase Mereka sebagian besar hemoprotein dengan aktivitas enzimatik yang mengkatalisasi oksidasi berbagai macam substrat organik dan anorganik menggunakan hidrogen peroksida atau zat terkait lainnya.
Dalam arti yang paling luas, istilah "peroksidase" termasuk enzim seperti NAD dan NADP-butxidases, asam lemak-butxidase, sitokrom-butxidase, glutathione-butxidases dan banyak enzim non-spesifik lainnya.
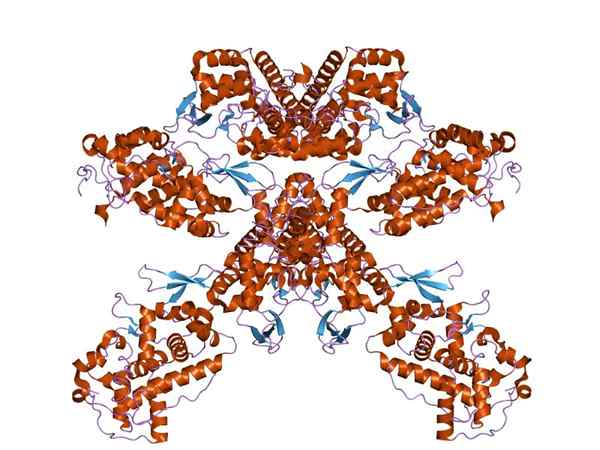
 Diagram hem-dependent tetapi peroksida
Diagram hem-dependent tetapi peroksida Namun, ini paling umum digunakan untuk merujuk pada enzim nonspesifik dari berbagai sumber yang memiliki aktivitas oksidortasi dan yang menggunakan hidrogen peroksida dan substrat lainnya untuk mengkatalisasi reaksi reduksi oksida mereka.
"Hemo-butxidases" sangat umum di alam. Mereka ditemukan pada hewan, tanaman atas, ragi, jamur dan bakteri.
Pada mamalia, ini diproduksi oleh leukosit, uterus, limpa dan hati, kelenjar ludah, dinding perut, paru -paru, kelenjar tiroid dan jaringan lainnya.
Pada tanaman, spesies tanaman terkaya di peroksidase adalah lobak pedas dan pohon ara. Peroksidase yang dimurnikan dari lobak pedas telah dipelajari secara luas dan digunakan untuk berbagai tujuan dalam biokimia eksperimental dan biokimia.
Dalam sel eukariotik, enzim penting ini biasanya ada di dalam.
[TOC]
Struktur
Terlepas dari homologi kecil yang ada antara berbagai jenis peroksidase, telah ditentukan bahwa struktur sekundernya dan cara yang diorganisir cukup diawetkan di antara spesies yang berbeda.
Ada beberapa pengecualian, tetapi sebagian besar peroksidase adalah glikoprotein dan diyakini bahwa karbohidrat berkontribusi pada stabilitasnya dibandingkan dengan suhu tinggi.
Protein ini memiliki bobot molekul mulai dari 35 hingga 150 kDa, yang setara dengan sekitar 250 dan 730 asam amino.
Dapat melayani Anda: membran plasmaDengan pengecualian myeloperoxidase, semua molekul jenis ini mengandung dalam strukturnya kelompok hemo yang dalam istirahat menyajikan atom besi dalam keadaan oksidasi Fe+3. Tanaman memiliki kelompok prostetik yang dikenal sebagai Ferroporfirina XI.
Peroksidase memiliki dua domain struktural yang "mengelilingi" kelompok hemo dan masing -masing domain ini adalah produk dari ekspresi gen yang menderita peristiwa duplikasi. Struktur ini terdiri dari lebih dari 10 aula alfa yang bergabung dengan loop dan belokan polipeptida.
Lipatan molekul yang memadai tampaknya tergantung pada adanya limbah glisin dan prolin yang diawetkan, serta residu asam aspartat dan arginin lainnya yang membentuk jembatan salin di antara mereka yang menghubungkan kedua domain struktural struktural.
Fungsi
Fungsi utama enzim peroksidase adalah penghapusan hidrogen peroksida dari lingkungan sel, yang dapat terjadi dengan mekanisme yang berbeda dan yang dapat mewakili ancaman serius terhadap stabilitas intraseluler.
Namun, dalam proses pengangkatan spesies oksigen reaktif ini (di mana oksigen memiliki keadaan oksidasi menengah) peroksidase menggunakan kapasitas pengoksidasi zat ini untuk memenuhi fungsi penting lainnya untuk metabolisme.
Pada tanaman, protein ini merupakan bagian penting dari proses lignifikasi dan mekanisme pertahanan dalam patogen yang terinfeksi dengan kerusakan fisik atau fisik.
Dalam konteks ilmiah, aplikasi baru telah muncul untuk peroksidase dan di antaranya adalah pengolahan air limbah yang mengandung senyawa fenolik, sintesis senyawa aromatik dan pengangkatan peroksida makanan atau bahan limbah.
Dalam istilah analitik dan diagnostik, peroksidase lobak pedas mungkin merupakan enzim yang paling banyak digunakan untuk persiapan antibodi terkonjugasi yang digunakan untuk tes penyerapan imunologis seperti ELISA (dari bahasa Inggris "Enzyme-linked Immunosorbent Assay") dan juga untuk penentuan berbagai jenis senyawa.
Dapat melayani Anda: Coanocytes: Karakteristik dan FungsiMekanisme aksi
Proses katalitik peroksidase terjadi melalui langkah -langkah berurutan yang dimulai dengan interaksi antara situs aktif enzim dan hidrogen peroksida, yang mengoksidasi atom besi dalam gugus hemo dan menghasilkan senyawa perantara yang tidak stabil yang dikenal sebagai senyawa I (IOC).
Protein teroksidasi (IOC) kemudian memiliki gugus hemo dengan atom besi yang beralih dari keadaan oksidasi III ke negara bagian IV dan untuk proses ini hidrogen peroksida ke air menjadi air berkurang.
Senyawa I mampu mengoksidasi substrat donor elektron, membentuk substrat radikal dan menjadi spesies kimia baru yang dikenal sebagai senyawa II (COII), yang kemudian dikurangi dengan molekul substrat kedua, meregenerasi zat besi di Negara Bagian III dan menghasilkan radikal lainnya.
Teman-teman
-Menurut organisme
Peroksidase dikelompokkan ke dalam tiga kelas tergantung pada organisme di mana mereka berada:
- Kelas I: peroksidase prokariotik intraseluler.
- Kelas II: Peroksidase jamur ekstraseluler.
- Kelas III: Peroksidase Sayuran Rahasia.
Bertentangan dengan protein Kelas I, yang dimiliki oleh Kelas II dan III dalam struktur mereka yang dibangun di antara residu sistein, yang memberi mereka kekakuan yang jauh lebih besar.
Protein Kelas II dan III juga berbeda dari kelas I di mana mereka biasanya memiliki glikosilasi di permukaannya.
-Menurut situs aktif
Berbicara mekanistik, peroksidase juga dapat dikategorikan sesuai dengan sifat atom yang ditemukan di pusat katalitiknya. Dengan cara ini, hemoperoksidase (yang paling umum), vanadium-haloproxidases dan lainnya telah dijelaskan.
Itu dapat melayani Anda: pinositosis: proses, fungsi dan perbedaan dengan fagositosisHemoperoxidases
Seperti yang telah disebutkan, peroksidase ini memiliki kelompok prostetik di pusat katalitik mereka yang dikenal sebagai Grupo Hemo. Atom besi di tempat ini dikoordinasikan oleh empat ikatan dengan atom nitrogen.
Vanadio-halperoxidases
Alih-alih kelompok hemo, vanadio-waterperoxidases memiliki vanadato sebagai kelompok prostetik. Enzim ini telah diisolasi dari organisme laut dan beberapa jamur tanah.
Vanadium dalam kelompok ini dikoordinasikan oleh tiga oksigeno non-proteik, nitrogen dari residu histidin dan nitrogen ikatan azid.
Peroksidase lainnya
Pada kelompok ini, banyak haryperoxidase bakteri yang memiliki kelompok prostetik selain hemo atau vanadium dikategorikan. Pada kelompok ini ada juga peroksidase glutathione.
Referensi
- Alberts, b., Dennis, b., Hopkin, k., Johnson, a., Lewis, J., Raff, m.,... Walter, P. (2004). Biologi Sel Esensial. Abingdon: Garland Science, Taylor & Francis Group.
- Bank, l. (1997). Sifat struktural peroksida. Jurnal Bioteknologi, 53, 253-263.
- Deurzen, m. P. J. Van, rantwijk, f. Van, & Sheldon, R. KE. (1997). Oksidasi selektif yang dikatalisis oleh peroksidase. Segi empat, 53(39), 13183-13220.
- Dunford, h. B., & Stillman, J. S. (1976). Pada fungsi dan mekanisme aksi peroksidase. Ulasan Koordinasi Kimia, 19, 187-251.
- Hamid, m., & Rehman, K. (2009). Aplikasi potensial peroksida. Kimia Makanan, 115(4), 1177-1186.
- Rawn, J. D. (1998). Biokimia. Burlington, Massachusetts: Penerbit Neil Patterson.
- Stansfield, w. D., Colomé, J. S., & Cano, R. J. (2003). Biologi molekuler dan sel. (K. DAN. Cullen, ed.). Ebooks McGraw-Hill.
- « Karakteristik Citocins, Jenis, Fungsi, Contoh
- Pelatihan dan degradasi GMP siklik, struktur, fungsi »

