Properti peroksida, nomenklatur, penggunaan, contoh
- 4422
- 1180
- Miss Wm Hudson
Itu peroksida Mereka semua adalah senyawa kimia yang mengandung gugus peroxo, O-O, baik secara kovalen terkait dengan atom karbon atau kelompok fungsional lainnya, atau dalam bentuk ionik seperti anion peroksida, atau22-. Di atas diwakili secara grafis pada gambar di bawah ini. Di dalamnya kelompok O-O menonjol dengan warna biru.
Mungkin ada peroksida organik seperti diaquilperoxides (r1-O-o-r2), Hidroperoksida (r-o-o-h), peracids (rco-o-o-h) dan peéstres (r1Co-o-o-r2). Kami juga memiliki peroksida anorganik, seperti peroksida logam (mN+SALAH SATU22-) dan hidrogen peroksida (H-O-H). Yang terakhir adalah yang paling terkenal dari semuanya, menerima nama hidrogen peroksida.
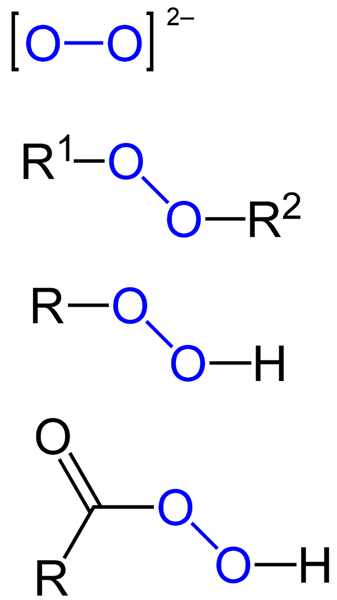 Rumus untuk berbagai jenis peroksida yang ada. Sumber: Jü / domain publik
Rumus untuk berbagai jenis peroksida yang ada. Sumber: Jü / domain publik Semua peroksida berbagi secara umum sifat menjadi sangat reaktif, zat pengoksidasi dan, dalam beberapa kasus, eksplosif. Kecuali jika mereka tidak ditentukan dengan mensintesisnya, mereka dianggap tidak diinginkan dan kotoran berbahaya untuk banyak proses industri dan untuk sintesis laboratorium.
Peroksida pada umumnya adalah agen pengoksidasi yang sangat baik, pemutih, bakterisida, dan aktivator polimerisasi melalui pembentukan radikal bebas. Itulah sebabnya mereka biasanya reagen atau aditif yang sangat berguna dalam industri polimer, serta dalam industri makanan untuk mempercepat oksidasi dan menghilangkan bakteri.
[TOC]
Sifat peroksida
Struktur
Struktur peroksida fokus di sekitar kelompok O-O. Setiap atom oksigen memiliki hibridisasi SP3, Jadi tautan -o -jangan beristirahat di bidang yang sama. Misalnya, untuk hidrogen peroksida, h-o-h, sudut yang terbentuk di antara keduanya adalah 115.5, yang menunjukkan bahwa keempat atom tidak ada di pesawat.
Distorsi sudut ini dan sudut lainnya akan tergantung pada identitas fragmen molekul lain yang terkait dengan kelompok O-O.
Itu dapat melayani Anda: Gibbs Free Energy: Unit, bagaimana itu dihitung, latihan terpecahkanDi sisi lain, peroksida organik dan anorganik (kecuali untuk logam) dapat dikenali dengan mata telanjang jika kelompok O-O dirinci dalam strukturnya, seperti dua gelas dengan "mulut". Dengan cara ini, setiap peroksida segera diidentifikasi dengan satu pandangan dari strukturnya.
Reaktivitas
Tautan O-O relatif lemah dibandingkan dengan tautan lain seperti C-H atau C-O. Itulah mengapa cenderung pecah atau fragmen untuk menghasilkan radikal teroksigenasi yang sangat reaktif.
Mereka karena radikal ini, peroksida diklasifikasikan sebagai zat reaktif dan berbahaya, karena mereka dapat merusak jaringan dan bahan organik apa pun secara umum.
Aksi pengoksidasi
Peroksida adalah agen pengoksidasi yang kuat, berusaha mendapatkan elektron dari lingkungan untuk berubah menjadi air, oksigen atau hidroksida. Misalnya, hidrogen peroksida adalah zat oksidan yang lebih kuat daripada kalium permanganat yang sama.
Tindakan pengoksidasi ini digunakan untuk mendeteksinya melalui reaksi mereka dengan besi sulfat dan kalium tiocyanate:
Peroksida +iman2+ + Scn- → Fe (SCN)N(3-N)- (N = 1 hingga 6).
Kompleks yang terbentuk antara iman3+ dan SCN- Ini merah darah, jadi pengamatan warna ini sesuai dengan tes positif untuk keberadaan peroksida dalam sampel.
Kepekaan
Peroksida adalah zat yang sensitif terhadap suhu tinggi dan sinar matahari. Oleh karena itu, mereka harus disimpan di lokasi yang aman dan di dalam wadah plastik dan buram, sehingga cahaya tidak secara langsung mempengaruhi mereka.
Tata nama
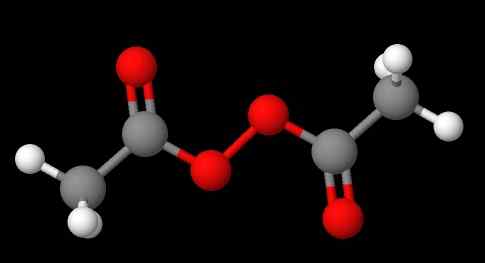
Nomenklatur peroksida tergantung pada jenisnya. Secara umum, banyak yang ditunjuk dengan menyebutkan 'peroksida' diikuti oleh substituen R dalam urutan abjad. Misalnya, senyawa ch3C (O) OOC (O) CH3 (Gambar yang lebih rendah) disebut diacetyl atau asetil peroksida, karena memiliki kelompok asetil di setiap ujungnya.
Dapat melayani Anda: natrium sulfat (na2so4): struktur, sifat, penggunaan, mendapatkan Diacetyl peroksida. Sumber: Gabriel Bolívar via Molview.
Diacetyl peroksida. Sumber: Gabriel Bolívar via Molview. Senyawa c6H5C (O) OOC (O) C6H5 (Gambar yang lebih rendah), di sisi lain, disebut dibenzoílo atau benzoílo peroksida, untuk alasan yang sama yang dinyatakan dalam paragraf sebelumnya.
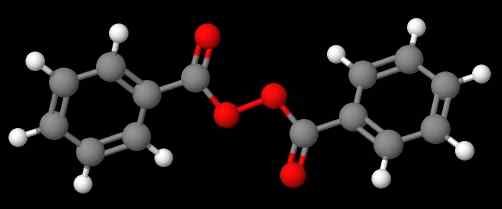 Benzoil peroksida. Sumber: Gabriel Bolívar via Molview.
Benzoil peroksida. Sumber: Gabriel Bolívar via Molview. Sementara itu, senyawa C6H5C (O) OOC (O) CH3 disebut asetil benzolelo peroksida. Kali ini substituen asetil disebutkan pertama kali untuk memulai dengan huruf 'a'. Contoh lain adalah ch3Ch2Ooc6H5, disebut etil fenil peroksida.
Demikian pula, lanjutkan dengan hidroperoksida. Misalnya, Cho3OOH disebut metil hidroperoksida.
Pelatihan
Beberapa peroksida dapat dibentuk langsung dengan paparan zat yang dimaksud dengan oksigen udara, dibantu atau tidak dengan katalis logam. Mereka juga dapat membentuk dengan mengekspos zat ke ozon dalam kondisi tertentu, melaksanakan reaksi ozonolisis.
Rute sintetis lainnya adalah bereaksi hidrogen peroksida dengan alkilorsulfat:
R2Sw4 + H2SALAH SATU2 → R-O-R +H2Sw4
Untuk mensintesis atau membentuk peroksida diakilat atau bahkan peroksida siklik.
Sementara itu, beberapa metode untuk membentuk peroksida logam didasarkan pada oksigenasi oksida logam masing -masing, sehingga mereka "oksigen" dan berubah dari menjadi mo (mN+SALAH SATU2-) Cinta2 (MN+SALAH SATU22-).
Penggunaan peroksida
Inisiator Polimerisasi
Peroksida, terutama peroksida organik, ditambahkan ke sarana reaksi untuk sintesis infinitas plastik dan bahan seperti polystyrene, silikon, epoksi dan resin akrilik, polivinil klorida, fiberglass, di antara yang lain.
Ini karena mereka menderita dekomposisi termal untuk menjadi radikal bebas teroksigenasi, yang pada gilirannya memicu dan mengkatalisasi polimerisasi. Oleh karena itu, mereka diinginkan dalam industri polimer.
Itu dapat melayani Anda: fraksi molar: bagaimana itu dihitung, contoh, latihanBeberapa peroksida yang digunakan sebagai inisiator adalah metil cetona (MEK) peroksida, dan aseton peroksida.
Pemutih dan desinfektan
Peroksida adalah agen pemutih, digunakan untuk kertas pemutih dan bubur tepung. Mereka juga agen desinfektan, benar -benar efektif tetapi agresif dalam hal pemusnahan bakteri. Contoh klasik sesuai dengan hidrogen peroksida, dimaksudkan dalam larutan encer (3%) untuk mendisinfeksi luka.
Agen pengoksidasi
Peroksida juga merupakan agen pengoksidasi, sehingga mereka menemukan banyak kegunaan dalam sintesis organik zat yang sangat teroksigenasi.
Sumber oksigen
Meskipun bukan di antara penggunaan utamanya, peroksida juga dapat berfungsi sebagai sumber oksigen di beberapa kerusakan mereka. Inilah yang terjadi, sekali lagi, dari hidrogen peroksida.
Contoh peroksida
Akhirnya, beberapa contoh peroksida akan terdaftar, apakah organik atau anorganik, dengan formula dan nama masing -masing:
-H2SALAH SATU2: Hidrogen atau hidrogen peroksida
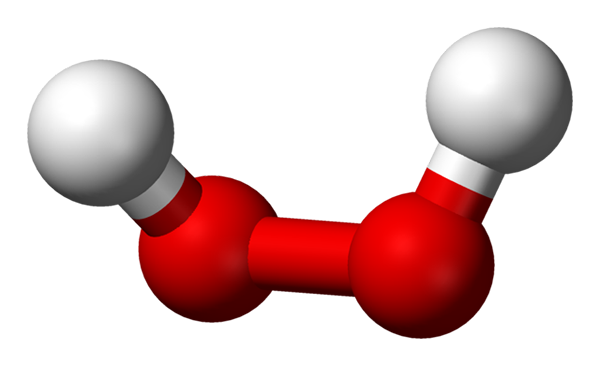 Molekul hidrogen peroksida diwakili dengan model bola dan batang. Sumber: Benjah-BMM27 via Wikipedia.
Molekul hidrogen peroksida diwakili dengan model bola dan batang. Sumber: Benjah-BMM27 via Wikipedia. -Na2SALAH SATU2: Sodium peroksida
-Balok2: Barium peroksida
-C6H5C (ch3)2OOH: cummeno hidroperoksida
-(NH4)2S2SALAH SATU8: Ammonium persulfate
- Ho3Sooso3H: Asam peroksidisulfuri
-(Ch3)3Cooc (ch3)3: Ditert-butyl peroxide
Referensi
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Peroksida organik. Diperoleh dari: di.Wikipedia.org
- Elsevier b.V. (2020). Peroksida. Ilmiah. Diperoleh dari: Scientedirect.com
- Pengembangan Kimia Tingkat Lanjut. (S.F.). Alkohol, fenol, dan perolehannya:
- Peroxides Aturan C-218. Pulih dari: acdlabs.com
- Vol'nov i.yo., Petrocelli a.W. (1966) Klasifikasi dan nomenklatur senyawa peroksida anorganik. Dalam: Petrocelli a.W. (Eds) peroksida, superoksida, dan ozonida logam alkali dan alkali tanah alkali. Springer, Boston, MA.
- « Khas Baja California Sur untuk Pria dan Wanita (Deskripsi)
- Properti penjualan haloid, nomenklatur, bagaimana mereka terbentuk, contoh »

