Berat setara
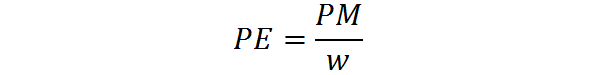
- 788
- 103
- Tommie Smith
Berapa bobot yang setara?
Dia berat setara Itu adalah berat atau massa yang setara dengan zat. Yaitu, berat atau massa zat yang secara kimia sama dengan 1 mol zat lain dari tipe yang sama yang digunakan sebagai pola referensi dan dianggap normal.
Zat normal yang diambil sebagai referensi tergantung pada jenis reaksi kimia yang terlibat dan peran yang dimainkan senyawa dalam reaksi itu. Senyawa normal selalu bereaksi satu sama lain dengan stoikiometri 1: 1.
Misalnya, jika kita berbicara tentang reaksi asam/basa, berat yang setara dari suatu asam akan menjadi berat senyawa tersebut yang setara dengan 1 mol asam normal, yang merupakan proton yang dapat terionisasi tunggal.
Sebelum diketahui bahwa materi dibentuk oleh atom dan molekul, serangkaian undang -undang yang menentukan hubungan massa (atau berat) antara reagen dan produk reaksi kimia telah ditetapkan.
Undang -undang ini membentuk basis perhitungan stoikiometri selama awal kimia sebagai sains.
Konsep berat yang setara terkait dengan tahap awal pengembangan kimia ini. Selanjutnya, kita akan membahas bagaimana itu dihitung, untuk apa dan beberapa contoh umum dari perhitungan Anda.
Formula dan unit berat yang setara
Berat ekuivalen dihitung dari berat molekul satu zat dengan menggunakan rumus berikut:
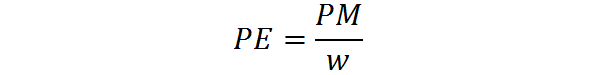
Di mana PE adalah berat setara, PM adalah berat molekul atau massa molar zat, dan W mewakili jumlah ekuivalen per mol.
Yang terakhir selalu terdiri dari bilangan bulat sama atau lebih besar dari 1. Ini mewakili jumlah molekul reagen "normal" yang mana setiap molekul zat setara. Oleh karena itu, itu tergantung pada jenis reagen yang dimaksud dan jenis reaksi kimia yang terlibat.
Dapat melayani Anda: dihydroxyacetone: struktur, properti, memperoleh, penggunaanIni juga dapat dihitung dari adonan, M, dan jumlah yang setara:
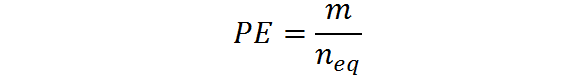
Unit berat yang setara
Seperti dapat dilihat dari formula sebelumnya, berat setara dinyatakan dalam unit massa (biasanya gram) pada jumlah yang setara. Yaitu, unitnya adalah G/EQ.
Nilai dari W Dalam rumus sebelumnya yang pertama diekspresikan dalam unit yang setara pada mol (Persamaan/mol), sedangkan massa molar diekspresikan dalam gram di atas mol (g/mol).
Untuk apa bobot yang setara?
Kegunaan utama dari bobot yang setara adalah menyederhanakan perhitungan stoikiometri. Berat yang setara dari suatu zat setara dengan zat lain dari tipe yang sama dan untuk jenis reaksi kimia yang sama. Faktanya, dari sana dia mendapatkan namanya.
Ini memungkinkan kami untuk melakukan perhitungan stoikiometri dengan cara yang sangat sederhana dan tanpa perlu menulis dan menyeimbangkan persamaan kimia.
Bagaimana berat setara dihitung?
Seperti yang kita lihat sebelumnya, berat setara dihitung dari berat molekul dan jumlah ekuivalen per mol atau w.
Perhitungan berat molekul
Berat molekul suatu zat ditentukan dengan menambahkan berat atom semua atom yang mengada -ada. Bobot atom ini ditemukan di tabel periodik.
Penentuan W
Nilai dari W Untuk suatu zat itu tergantung pada jenis reaksi di mana ia terlibat. Artinya, itu tergantung pada jenis reagen yang dimaksud. Untuk setiap jenis zat ada cara yang berbeda untuk menentukan W.
Tabel berikut menunjukkan bagaimana itu ditentukan W Untuk kasus yang berbeda.
Itu dapat melayani Anda: kalsium hipoklorit (ca (clo) 2)| Jenis reagen | Nilai dari W |
| Asam | Jumlah hidrogen terionisasi untuk setiap molekul asam. |
| Pangkalan | Jumlah proton yang dapat menangkap atau menetralkan setiap molekul dasar. |
| Agen pengoksidasi | Jumlah elektron yang menangkap setiap mol zat pengoksidasi dalam semi -retaksi reduksi. |
| Agen pereduksi | Jumlah elektron yang dilepaskan setiap mol zat pereduksi dalam semi -retraction oksidasi. |
| Kamu keluar | Jumlah total muatan positif atau negatif yang dihasilkan saat salah satu garam. |
| Zat netral | 1 |
Perlu dicatat bahwa, jika suatu zat dapat berpartisipasi dalam lebih dari satu jenis reaksi kimia, ia mungkin memiliki lebih dari satu nilai W Dan, oleh karena itu, lebih dari satu bobot yang setara.
Pentingnya dan aplikasi berat setara
Berat ekuivalen digunakan untuk menghitung jumlah ekuivalen suatu bahan kimia. Jumlah kesetaraan ini selalu sama dengan jumlah ekuivalen zat lain yang bereaksi.
Ini terutama digunakan di dua bidang yang berbeda:
Dalam kimia analitik
Ekuivalen sering digunakan untuk memfasilitasi perhitungan stoikiometri dalam kimia analitik. Ini terutama berlaku dalam kasus analisis volumetrik dan gravimetri.
Pengetahuan tentang volume tingkat pada titik kesetaraan dan konsentrasi tituler, serta berat setara dari yang berhak, dengan mudah memungkinkan untuk menghitung massa analit yang ada dalam sampel.
Dalam elektrolisis
Di bidang elektrolisis, berat setara mewakili berat satu logam atau zat lain yang dapat terjadi ketika 96.500 C pemuatan melalui sel elektrolitik. Ini memfasilitasi perhitungan stoikiometrik dan ekonomi dari proses elektrolisis.
Dapat melayani Anda: Merkurius oksida (HG2O)Contoh perhitungan berat badan yang setara
Kalsium
Berat atom kalsium adalah 40 dan logam ini membentuk kation dengan valencia +2, sehingga berat setara adalah 40/2 = 20 g/eq.
Asam sulfat (h2Sw4)
Berat molekul senyawa ini adalah 98 dan merupakan asam diprotik, jadi W = 2. Oleh karena itu, berat setara adalah PE: 98/2 = 49 g/Persamaan.
Aluminium hidroksida (AL (OH)3)
Aluminium hidroksida (PM = 78) adalah senyawa amfoter yang dapat bertindak sebagai asam dan sebagai basa.
Jika Anda bertindak sebagai basis dengan melepaskan tiga hidroksida Anda, maka W = 3, Jadi PE: 78/3 = 26 g/Persamaan. Di sisi lain, ketika bertindak sebagai asam, ia menangkap molekul air dan melepaskan proton, jadi, dalam hal ini, W = 1 dan PE = 78 g/Persamaan.
Kalsium fosfat (CA3(PO4)2)
Kalsium fosfat adalah garam yang, saat memisahkan, menghasilkan ion 3 Ca2+ dan 2 ion PO43-.
Bagaimanapun, jumlah beban dari tanda yang sama yang dihasilkan oleh setiap unit kalsium fosfat adalah 6, jadi W = 6 dan PE = 310/6 = 51.67 g/Persamaan.
Referensi
- Encyclopedia universal (s. F.). Berat setara. Diambil dari ensiklopedia_universal.ES-Academic.com.
- Kimia, Kimia Anorganik (S. F.). Berat setara. Diambil dari fullquimica.com.
- Kimia.Itu (s. F.). Setara. Diambil dari chemistry.adalah.
- Spiegato (2021). Berapa bobot yang setara? Diambil dari Spiegato.com.

