Polaritas (Kimia) Apa itu, Definisi, Contoh
- 2711
- 227
- Ernesto Mueller
Apa itu polaritas kimia?
Itu Polaritas Kimia Ini adalah properti yang ditandai dengan adanya distribusi kepadatan elektronik heterogen yang ditandai dalam molekul. Dalam strukturnya, oleh karena itu, ada daerah yang dimuat secara negatif (Δ-), dan yang lainnya bermuatan positif (Δ+), menghasilkan momen dipol.
Momen dipol (µ) dari tautan adalah bentuk ekspresi polaritas molekul. Biasanya direpresentasikan sebagai vektor yang aslinya berada di beban (+) dan ujungnya terletak di beban (-), meskipun beberapa bahan kimia mewakilinya secara terbalik.
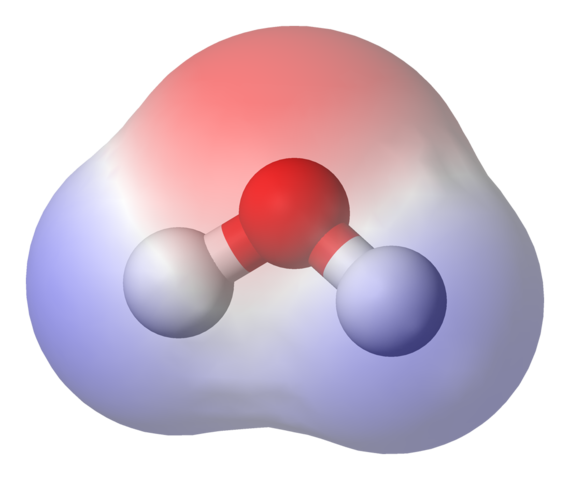
 Peta potensial elektrostatik untuk molekul air. Sumber: Benjah-BMM27 via Wikipedia.
Peta potensial elektrostatik untuk molekul air. Sumber: Benjah-BMM27 via Wikipedia. Pada gambar atas peta potensial elektrostatik untuk air ditampilkan, h2SALAH SATU. Wilayah kemerahan (atom oksigen) sesuai dengan yang ada dengan kepadatan elektronik tertinggi, dan juga dapat dilihat bahwa ia menonjol di daerah biru (atom hidrogen).
Karena distribusi kepadatan elektronik tersebut heterogen, dikatakan bahwa ada kutub yang positif dan negatif. Itulah sebabnya kita berbicara tentang polaritas kimia, dan untuk saat ini dipol.
Momen dipolar
Momen dipol µ didefinisikan oleh persamaan berikut:
µ = Δ ·D
Di mana δ adalah muatan listrik dari masing-masing kutub, positif (+δ) atau negatif (-Δ), dan D Itu adalah jarak di antara mereka.
Momen dipol biasanya diekspresikan dalam debye, diwakili oleh simbol d. A Coulomb · Metro setara dengan 2.998 · 1029 D.
Nilai momen dipol dari hubungan antara dua atom yang berbeda adalah dalam kaitannya dengan perbedaan elektronegativitas atom yang membentuk tautan.
Agar molekul menjadi kutub, tidak cukup memiliki hubungan kutub dalam strukturnya, tetapi juga harus memiliki geometri asimetris; sedemikian rupa, itu mencegah momen dipol satu sama lain.
Dapat melayani Anda: karbonoid: elemen, karakteristik dan penggunaanAsimetri dalam molekul air
Molekul air memiliki dua ikatan O-H. Geometri molekul adalah sudut, yaitu, dengan bentuk "V"; Jadi momen dipol dari tautan tidak saling membatalkan, tetapi jumlahnya terjadi dengan menunjuk ke arah atom oksigen.
Peta potensial elektrostatik untuk h2Atau mencerminkan ini.
Jika molekul sudut H-O-H diamati, pertanyaan berikut dapat muncul: apakah itu benar-benar asimetris? Jika sumbu imajiner ditarik yang melintasi atom oksigen, molekul akan dibagi menjadi dua bagian yang sama: h-o | o-h.
Tapi, tidak demikian halnya jika sumbu imajiner horizontal. Ketika sumbu ini sekarang membagi molekul lagi menjadi dua bagian, atom oksigen akan ada di satu sisi, dan di sisi lain dua atom hidrogen.
Inilah sebabnya simetri yang jelas dari h2Atau tidak ada lagi, dan oleh karena itu molekul asimetris dipertimbangkan.
Molekul kutub
Molekul polar harus memenuhi serangkaian karakteristik, seperti:
-Distribusi muatan listrik dalam struktur molekul asimetris.
-Mereka biasanya larut dalam air. Ini karena antara molekul kutub dapat berinteraksi dengan gaya dipol-dipolo, di mana air ditandai dengan memiliki momen dipol yang besar.
Selain itu, konstanta dielektriknya sangat tinggi (78.5), yang memungkinkan Anda mempertahankan beban listrik yang terpisah meningkatkan kelarutannya.
-Secara umum, molekul kutub memiliki titik didih dan fusi yang tinggi.
Kekuatan-kekuatan ini dibentuk oleh interaksi dipolo-dipolo, kekuatan dispersif London dan pembentukan jembatan hidrogen.
Dapat melayani Anda: besi sulfat (feso4): apa itu, struktur, sifat, sintesis-Karena muatan listriknya, molekul kutub dapat menggerakkan listrik.
Contoh
Sw2
Sulfur dioksida (jadi2). Oksigen memiliki elektronegativitas 3,44, sedangkan elektronegativitas sulfur adalah 2,58. Oleh karena itu, oksigen lebih elektronegatif daripada belerang. Ada dua tautan s = o, memiliki atau satu beban Δ- dan s a beban Δ+.
Karena merupakan molekul sudut dengan S di titik, dua momen dipol berorientasi pada arah yang sama; Dan karena itu, mereka bertambah, membuat molekul2 jadilah kutub.
Chcl3
Kloroform (hccl3). Ada tautan C-H dan tiga tautan C-CL.
Elektronegativitas C adalah 2.55, dan elektronegativitas H adalah 2.2. Dengan demikian, karbon lebih elektronegatif daripada hidrogen; Dan oleh karena itu, momen dipol akan berorientasi dari h (Δ+) ke c (Δ-): cδ--Hδ+.
Dalam kasus tautan C-CL, C memiliki elektronegativitas 2,55, sedangkan CL memiliki elektronegativitas 3,16. Momen dipol atau dipol berorientasi dari C ke CL di tiga tautan C δ+-Cl δ-.
Ketika ada daerah elektron yang buruk, di sekitar atom hidrogen, dan daerah yang kaya elektron yang terdiri dari tiga atom klor, CHCL3 Itu dianggap sebagai molekul kutub.
HF
Hidrogen fluoride hanya memiliki satu ikatan H-F. Elektronegativitas H adalah 2,22 dan elektronegativitas F adalah 3,98. Oleh karena itu, fluoride berakhir dengan kepadatan elektronik terbesar, dan hubungan antara kedua atom paling baik digambarkan sebagai: hδ+-Fδ-.
Dapat melayani Anda: aluminium hidroksida: struktur, sifat, penggunaan, risikoNH3
Amonia (NH3) memiliki tiga tautan N-H. Elektronegativitas N adalah 3,06 dan elektronegativitas H adalah 2,22. Dalam tiga ikatan, kepadatan elektronik berorientasi pada nitrogen, bahkan lebih besar dengan adanya sepasang elektron bebas.
Molekul NH3 Ini adalah tetrahedral, dengan atom N yang menempati simpul. Tiga momen dipol, yang sesuai dengan tautan N-H, berorientasi pada arah yang sama. Di dalamnya, Δ- terletak di n, dan Δ+ di h. Jadi, tautannya adalah: nδ--Hδ+.
Momen dipol ini, asimetri molekul, dan torsi bebas elektron pada nitrogen, menjadikan amonia molekul yang sangat polar.
Makromolekul dengan heteroátomos
Ketika molekulnya sangat besar, tidak lagi akurat untuk mengklasifikasikannya sebagai apolar atau kutub dalam diri mereka sendiri. Ini karena mungkin ada bagian dari strukturnya dengan karakteristik apolar (hidrofobik), seperti kutub (hidrofilik).
Jenis senyawa ini dikenal sebagai amphiphilos atau amphipatic. Karena bagian apolar dapat dianggap buruk dalam elektron sehubungan dengan bagian kutub, ada polaritas yang ada dalam struktur, dan senyawa amphiprylic dianggap sebagai senyawa kutub.
Dapat diharapkan secara umum bahwa makromolekul dengan heteroatom memiliki momen dipol, dan dengan itu, polaritas kimia.
Heteroátomos dipahami oleh mereka yang berbeda dari mereka yang membentuk kerangka struktur. Misalnya, kerangka berkarbonasi secara biologis yang paling penting dari semua, dan atom dengan siapa karbon (selain hidrogen) hubungan, itu disebut heteroátomo.
Referensi
- Senyawa kutub dan nonpolar. St. Louis Community College. Dipulihkan dari: pengguna.STLCC.Edu
- Bagaimana menjelaskan polaritas. Ilmu pengetahuan. Pulih dari: ilmuwan.com

