Jenis proses adiabatik, contoh, latihan diselesaikan
- 3499
- 753
- Irvin Reichel
A Proses adiabatik Itu adalah salah satu di mana tidak ada pertukaran panas antara sistem dan lingkungannya, baik karena itu terjadi dalam media isolasi, atau karena lewat dengan sangat cepat. Ini berarti bahwa di sekitar sistem, ini adalah bagian dari alam semesta yang diteliti, perubahan suhu tidak boleh dirasakan, tetapi hanya pekerjaan.
Ini adalah salah satu proses dasar termodinamika. Berbeda dengan proses lain (isocoric, isobarik dan isotermal), tidak ada variabel fisiknya yang tetap konstan; yaitu, besaran tekanan, volume, suhu dan perubahan entropi saat proses adiabatik berkembang.
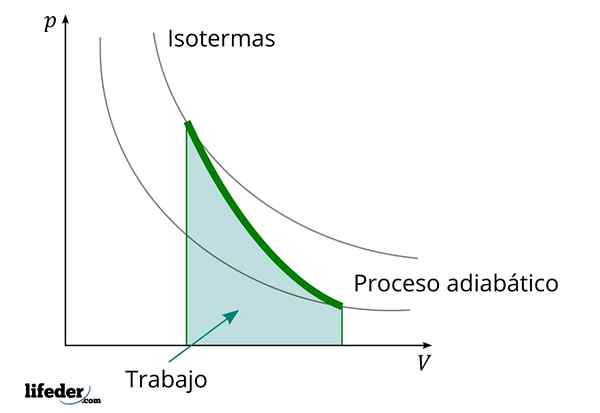
 Selama proses adiabatik di mana volume meningkat, energi internal zat yang dikurangi pekerjaan
Selama proses adiabatik di mana volume meningkat, energi internal zat yang dikurangi pekerjaan Karakteristik penting lain dari proses adiabatik adalah bahwa mereka melakukan atau mengonsumsi pekerjaan secara proporsional dengan variasi energi internal sistem mereka; Dalam hal ini, dari molekulnya dalam fase gas. Ini dapat ditunjukkan berkat hukum termodinamika pertama.
Dalam kehidupan sehari -hari, jenis proses ini mencakup semua untuk fenomena geofisika dan, sampai batas tertentu, fungsi piston di mesin diesel. Perpindahan panas sering dicegah dengan penggunaan media isolasi, tetapi kecepatan proses inilah yang memungkinkan perkembangan sebenarnya.
[TOC]
Proses adiabatik yang dapat dibalik dan tidak dapat diubah
Reversibel
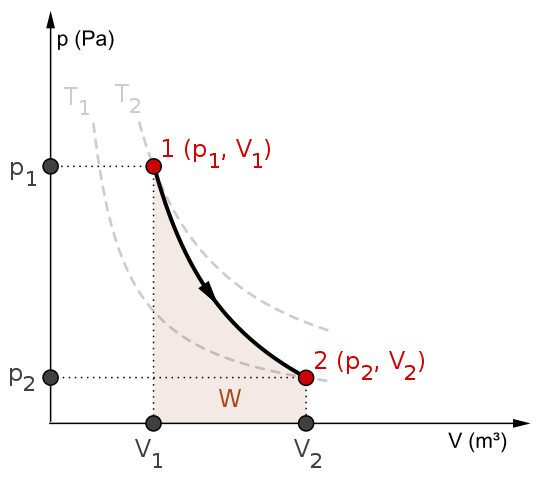 Diagram P-V dan bekerja untuk proses adiabatik. Sumber: mikerun/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0)
Diagram P-V dan bekerja untuk proses adiabatik. Sumber: mikerun/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0) Proses adiabatik dapat reversibel atau tidak dapat diubah. Namun, yang pertama hanya ada sebagai alat teoretis untuk mempelajari yang terakhir. Dengan demikian, proses adiabatik reversibel melibatkan gas ideal, dan kekurangan gesekan dan kemungkinan lainnya yang menyebabkan perpindahan panas antara sistem dan sekitarnya.
Pertimbangkan, misalnya, diagram P-V untuk proses adiabatik yang dapat dibalik dari atas. T1 dan T2 sesuai dengan dua isoterm, di mana tekanannya P dan volume V sistem bervariasi.
Di antara negara bagian (p1, V1) Dan p2, V2) Ekspansi adiabatik reversibel dilakukan, karena kami beralih dari volume V1 untuk satu v2, lebih besar, mengikuti arah panah.
Dengan melakukan itu, sistem mendingin, tetapi tanpa mematuhi perilaku isoterm. Area di bawah kurva sesuai dengan pekerjaan W, yang nilainya positif karena merupakan ekspansi.
Dalam proses ini entropi tetap konstan dan, oleh karena itu, dikatakan bahwa itu adalah isontropik. Pemrosesan matematika dari reversibilitas ini menghasilkan serangkaian persamaan yang dimungkinkan untuk mengevaluasi sistem lain.
Dapat melayani Anda: sel elektrolitikTidak dapat diubah
Proses adiabatik ireversibel, tidak seperti yang reversibel, tidak grafik dalam diagram P-V dengan garis kontinu tetapi putus-putus, karena hanya keadaan akhir dan awal yang memiliki variabel mereka (P, V dan T) yang didefinisikan dengan baik. Proses -proses ini melibatkan gas nyata, sehingga persamaan gas ideal dan derivasinya tidak secara langsung berlaku untuk mereka.
Mereka lulus dengan cepat, mencegah perpindahan panas antara sistem dan lingkungannya. Juga, di dalamnya entropi meningkat, sebagaimana dinyatakan dalam hukum termodinamika kedua.
Contoh proses adiabatik
 Kapasitas isolasi, seperti yang disajikan oleh termos, adalah salah satu faktor kunci untuk proses untuk mengembangkan secara adiabatik
Kapasitas isolasi, seperti yang disajikan oleh termos, adalah salah satu faktor kunci untuk proses untuk mengembangkan secara adiabatik Beberapa contoh proses adiabatik akan disebutkan di bawah ini.
Ekspansi dan pengertian
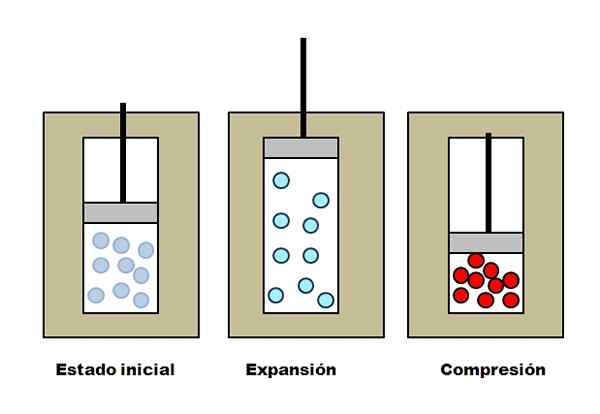 Ekspansi dan pemahaman adiabatik. Sumber: Gabriel Bolívar.
Ekspansi dan pemahaman adiabatik. Sumber: Gabriel Bolívar. Misalkan tiga rompi isolasi yang mengandung kompartemen penuh dengan gas. Dalam keadaan awal, piston tidak memiliki tekanan pada gas. Kemudian, piston dibiarkan naik, yang meningkatkan volume di mana molekul gas dapat bergerak, menyebabkan penurunan energi internalnya; Dan karena itu, penurunan suhu.
Yang sebaliknya terjadi dengan kompresi adiabatik: piston melakukan pekerjaan pada gas, mengurangi volume yang dapat ditempati molekulnya. Energi internal kali ini meningkat, yang juga menyiratkan peningkatan suhu, yang panasnya tidak dapat menyebar ke lingkungan karena rompi isolasi.
Ascent Magma
Saluran tempat magma naik di dalam gunung berapi yang diceritakan sebagai media isolasi, yang mencegah perpindahan panas antara magma dan atmosfer.
Suara menyebar
Gas -gas tersebut terganggu dan diperluas sesuai dengan gelombang suara tanpa mendinginkan atau panas udara yang mengelilinginya.
Efek Foehn
Efek foehn adalah contoh proses adiabatik di bidang geofisika. Massa udara naik ke bagian atas gunung di mana mereka mengalami lebih sedikit tekanan, sehingga molekul mereka meluas dan dingin, menimbulkan pembentukan awan.
Namun, mereka nyaris tidak turun di sisi lain gunung, tekanan meningkat dan, oleh karena itu, molekul dikompresi dan menaikkan suhu, menyebabkan awan menghilang.
Dapat melayani Anda: chlorobenzene (c6h5cl)Dalam video berikut, fenomena ini dapat dihargai:
Latihan terpecahkan
Akhirnya, beberapa latihan akan diselesaikan. Penting untuk memiliki persamaan berikut:
ΔU = Q - W (Hukum Termodinamika Pertama)
Tetapi tidak memiliki perpindahan panas, q = 0 y:
ΔU = - w (1)
Ini adalah: jika pekerjaan W positif, ΔU negatif, dan sebaliknya. Di sisi lain, kami juga memiliki:
W = -NCVΔt (2)
Bahwa setelah menerapkan persamaan gase ideal (PV = NRt), dan mengganti dan memecahkan untuk t2 dan T1 kami akan memiliki:
W = (cV/R) (p1V1 - P2V2) (3)
Menjadi nilai r sama dengan 0.082 l · atm/mol · k atau 8.314 j/mol · k
Dalam proses adiabatik, penting untuk mengetahui hubungan CP/CV dikenal sebagai γ:
γ = cP/CV (4)
Yang memungkinkan membangun hubungan T-V dan P-V:
T1V1γ-1 = T2V2γ-1 (5)
P1V1γ = P2V2γ (6)
Dan juga, perkiraan panas CP dan CV Mereka bervariasi tergantung pada apakah gasnya monoatomik, diatomik, dll.
Latihan 1
Gas melakukan 600 J pekerjaan melalui kompartemen yang terisolasi. Apa perubahan energi internalnya? Apakah suhu menurun atau meningkat? Dan mengingat bahwa itu adalah gas monoatomik, juga menghitung γ.
Data:
W = +600j
ΔU = ¿?
γ =?
Pekerjaan W adalah positif karena gas bekerja di sekitarnya. Berada di dalam kompartemen yang terisolasi, q = 0, dan oleh karena itu kita akan memiliki persamaan (1):
ΔU = - w
Artinya, ΔU sama dengan:
ΔU = - (+600J)
= -600J
Yang berarti bahwa energi internal gas menurun 600 J. Jika ΔU berkurang, begitu pula suhunya, jadi gas mendingin karena telah melakukan pekerjaan.
Karena gas ini monoatomik,
CV = 3/2 r
CP = 5/2 r
Dan menjadi
γ = cP/CV
= (5/2 r)/(3/2 r)
= 5/3 atau 1.66
Latihan 2
Dalam wadah 7 mol O2 Mereka dikompresi dari volume 15 liter hingga 9 liter. Mengetahui bahwa suhu awal adalah 300 K, Hitung: Pekerjaan yang dilakukan dengan gas.
Data:
N = 7 mol atau2
T1 = 300 k
V1 = 15 l
V2 = 9 l
W = ¿?
Ini adalah pemahaman adiabatik yang tidak dapat diubah. Kami memiliki dua persamaan untuk menyelesaikan W:
W = -NCVΔt (2)
W = (cV/R) (p1V1 - P2V2) (3)
Tekanan dapat menghitungnya, tetapi untuk menghemat waktu, lebih baik untuk melanjutkan dengan persamaan pertama:
Dapat melayani Anda: air sulingW = -NCVΔt
= -NCV (T2-T1)
Kita membutuhkan cV dan T2 Untuk menentukan w. Oksigen, menjadi gas diatomik, memiliki cV sama dengan 5/2 r:
CV (SALAH SATU2) = 5/2 r
= 5/2 (8.314 j/mol · k)
= 20.785 j/mol · k
Kita perlu menghitung t2. Kami beralih ke Persamaan (5):
T1V1γ-1 = T2V2γ-1
Tetapi sebelum menggunakannya, Anda harus menentukan c pertamaP dan γ:
CP (SALAH SATU2) = 7/2 r
= 7/2 (8.314 j/mol · k)
= 29.099 j/mol · k
Menjadi γ setara dengan:
γ = cP/CV
= (29.099 J / mol · k) / 20.785 j/mol · k
= 1.4
Jadi, kami bisa menghapus ini2 Dari Persamaan (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1)
= [(300k) (15L)1.4-1] / (9l)1.4-1
= 368.01 k
Dan akhirnya kami menyelesaikan untuk W:
W = -NCVΔt
= -(7 mol o2)( dua puluh.785 j/mol · k) (368.01 K - 300 K)
= -9895.11 J O -9.895 kJ
Latihan 3
Wadah neon memperluas adiabatik dan awalnya pada suhu kamar (t = 298K) dari 12 L menjadi 14 L. Mengetahui bahwa tekanan awalnya adalah 3 atm, apa yang akan menjadi pekerjaan yang dilakukan oleh gas?
Data:
T1 = 298 k
V1 = 12 l
V2 = 14 l
P1 = 3 atm
W = ¿?
Persamaan (3) memungkinkan kita untuk menentukan W dengan nilai -nilai tekanan:
W = (cV/R) (p1V1 - P2V2)
Tapi kami hilang cV Dan p2.
Tekanan akhir dapat dihitung dengan persamaan (6):
P1V1γ = P2V2γ
Menjadi γ setara dengan cP/CV. Karena neon adalah gas monoatomik, kami memiliki nilai C -nyaP dan CV Mereka masing -masing 5/2r dan 3/2r. Kami menghitung kemudian γ:
γ = cP/CV
= (5/2r)/(3/2r)
= 5/3 atau 1.66
Kami membersihkan hal2 Dari Persamaan (6):
P2 = (P1V1γ) / V2γ
= [(3 atm) (12 L)5/3] / (14 l)5/3
= 1.40 atm
Dan pekerjaan akan sama dengan:
W = (cV/R) (p1V1 - P2V2)
= (3/2) [(3 atm) (12 L) - (1.40 atm) (14 l)] (101300 pa/1 atm) (0.001 m3/L) (kJ/1000 j)
= 2.49 kJ
Faktor konversi digunakan untuk mengonversi l · atm a pa · m3, yang setara dengan 1 j. Gas neon mengembang, sehingga tekanannya berkurang dan, saat melakukan pekerjaan di sekitarnya, ini positif. Juga, energi internalnya ΔU berkurang, serta suhunya, pendinginan dalam proses ekspansi.
Referensi
- Walter J. Moore. (1963). Kimia Fisik. Dalam Kinetika Kimia. Edisi Keempat, Longmans.
- Iran. Levine. (2009). Prinsip -prinsip fisikokimia. Edisi Keenam. MC Graw Hill.
- Wikipedia. (2020). Proses adiabatik. Diperoleh dari: di.Wikipedia.org
- Jones, Andrew Zimmerman. (18 Agustus 2020). Themodynamics: Proses adiabatik. Pulih dari: thinkco.com
- Devoe Howard & Neils Tom. (9 Agustus 2020). Perubahan adiabatik. Libretteks Kimia. Pulih dari: chem.Librettexts.org

