Titik kesetaraan

- 3021
- 162
- Joseph Nader PhD
 Titik kesetaraan adalah konsentrasi nilai tambah stoikiometri sama dengan jumlah analit
Titik kesetaraan adalah konsentrasi nilai tambah stoikiometri sama dengan jumlah analit Apa titik kesetaraan?
Dia titik kesetaraan Itu adalah satu di mana dua zat kimia telah sepenuhnya bereaksi. Dalam reaksi asam-basa, titik ini menunjukkan kapan asam utuh atau basa telah dinetralkan.
Konsep ini setiap hari dalam derajat atau penilaian volumetrik, dan ditentukan oleh perhitungan matematika sederhana.
Dalam hal ini, derajat adalah proses di mana volume larutan konsentrasi yang diketahui ditambahkan dengan hati -hati, disebut tituler, ke larutan konsentrasi yang tidak diketahui, untuk mendapatkan konsentrasinya.
Penggunaan indikator pH memungkinkan untuk mengetahui momen di mana derajat berakhir. Indikator ditambahkan ke solusi yang diberi judul untuk melakukan kuantifikasi konsentrasi yang ingin Anda ketahui.
Indikator asam-basa adalah senyawa kimia yang warnanya tergantung pada konsentrasi hidrogen atau pH medium.
Perubahan warna indikator menunjukkan titik akhir derajat, meskipun bukan titik kesetaraan. Idealnya, kedua titik harus bertepatan, tetapi dalam kenyataannya, perubahan warna dapat terjadi beberapa tetes setelah netralisasi asam atau basa telah selesai.
Apa titik kesetaraan?
Larutan asam konsentrasi yang tidak diketahui ditempatkan dalam labu.
Pemilihan indikator harus dilakukan sedemikian rupa sehingga mengubah warna pada titik bahwa jumlah yang sama dari ekuivalen kimia dari larutan titrasi dan larutan konsentrasi yang tidak diketahui telah bereaksi.
Ini adalah titik kesetaraan, sedangkan titik di mana indikator berubah warna disebut titik akhir, di mana titling berakhir.
Dapat melayani Anda: Solusi Hipotonik: Komponen, Persiapan, ContohPoin terakhir
Ionisasi atau disosiasi indikator direpresentasikan sebagai berikut:
Hin +h₂o di- + H3SALAH SATU+
Dan karena itu memiliki ka konstan
Ka = [h3SALAH SATU+] [Di dalam-] / [Hin]
Hubungan antara indikator non -disosiasi (HIN) dan indikator yang terdisosiasi (IN-) Tentukan warna indikator.
Penambahan asam meningkatkan konsentrasi HIN dan menghasilkan warna 1 dari indikator. Sementara itu, penambahan basis mendukung peningkatan konsentrasi indikator yang terdisosiasi (dalam-) (Warna 2).
Diinginkan bahwa titik kesetaraan bertepatan dengan titik akhir. Untuk melakukan ini, indikator dipilih dengan interval perubahan warna yang mencakup titik kesetaraan. Selain itu, ini tentang mengurangi kesalahan yang menghasilkan perbedaan antara titik kesetaraan dan titik akhir.
Standardisasi atau penilaian suatu solusi adalah proses di mana konsentrasi yang tepat dari suatu larutan ditentukan. Secara metodologis adalah gelar, tetapi strategi yang diikuti berbeda.
Solusi dari standar primer ditempatkan di labu dan solusi tituler yang distandarisasi ditambahkan dengan burette.
Kesetaraan titrasi asam kuat dengan basa yang kuat
100 mL 0,1 M HCl ditempatkan di labu dan ditambahkan secara bertahap, dengan menggunakan burette, larutan NaOH 0,1 M, menentukan perubahan pH larutan yang menyebabkan asam klorida hidroklorat.
Awalnya, sebelum menambahkan NaOH, pH solusi HCl adalah 1.
Basa yang kuat (NaOH) ditambahkan dan pH secara bertahap meningkat, tetapi tetap pH asam, karena asam berlebih menentukan pH ini.
Dapat melayani Anda: kalium iodida (ki): struktur, sifat, memperoleh, menggunakan, risikoJika NaOH berlanjut, ada waktu ketika titik kesetaraan tercapai, di mana pH netral (pH = 7). Asam telah bereaksi dengan basa yang memakan, tetapi belum ada basa berlebihan.
Konsentrasi natrium klorida mendominasi, yang merupakan garam netral (atau Na+ atau cl- dihidrolisis).
Jika NaOH berlanjut, pH terus meningkat, menjadi lebih mendasar daripada titik kesetaraan, karena konsentrasi NaOH mendominasi.
Idealnya, perubahan warna indikator harus terjadi pada pH = 7, tetapi karena bentuk mendadak dari kurva titling, fenolftalein dapat digunakan yang berubah menjadi warna merah muda pucat menjadi pH sekitar 8.
Kurva derajat berbasis lemah jatuh
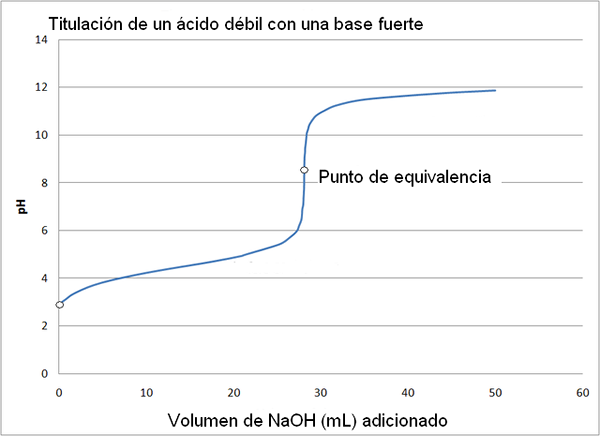 Asam lemah dan kurva titrasi basa kuat. Sumber: Wikimedia Commons
Asam lemah dan kurva titrasi basa kuat. Sumber: Wikimedia Commons Kurva titrasi asam kuat dengan basa kuat mirip dengan gambar atas. Satu -satunya perbedaan antara kedua kurva adalah bahwa yang pertama memiliki perubahan pH yang jauh lebih mendadak, sedangkan dalam kurva titrasi asam lemah dengan basa yang kuat, dapat dilihat bahwa perubahannya lebih bertahap.
Dalam hal ini asam lemah berjudul, seperti asam asetat (CH3COOH) dengan dasar yang kuat, natrium hidroksida (NaOH). Reaksi yang terjadi dalam derajat dapat ditentukan sebagai berikut:
NaOH +ch3Cooh => ch3Mendekut-Na+ + H₂o
Dalam hal ini, solusi buffer asetat dibentuk dengan pKa = 4,74. Wilayah empuk dapat dilihat dalam sedikit perubahan dan hampir tidak terlihat sebelum pH 6.
Itu dapat melayani Anda: grup amino (NH2): struktur, properti, contohTitik kesetaraan, seperti yang ditunjukkan oleh gambar, adalah sekitar 8,72 dan bukan 7. Ini karena cho3Mendekut- Itu adalah anion yang setelah Hydrolyzar menghasilkan oh-, yang mendasarkan pH:
Ch3Mendekut- + H₂o ch3COOH +OH-
Tahapan
Titrasi asam asetat oleh natrium hidroksida dapat dibagi menjadi 4 tahap untuk analisis.
- Sebelum mulai menambahkan basa (NaOH), pH larutan bersifat asam dan tergantung pada disosiasi asam asetat.
- Ketika natrium hidroksida ditambahkan, larutan redaman asetat terbentuk, tetapi dengan cara yang sama pembentukan basis asetat terkonjugasi meningkat, yang membawa peningkatan larutan larutan larutan tersebut.
- PH titik kesetaraan terjadi hingga pH 8,72, yang terus terang basa.
Titik kesetaraan tidak memiliki nilai konstan dan bervariasi tergantung pada senyawa yang terlibat dalam derajat.
- Dengan terus menambahkan NaOH, setelah mencapai titik kesetaraan, pH meningkat karena kelebihan natrium hidroksida.
Pemilihan indikator sesuai dengan titik kesetaraan
Phenolphthalein berguna dalam menentukan titik kesetaraan dalam tingkat ini, karena memiliki titik belokan warnanya dalam pH sekitar 8, yang termasuk dalam area pH titrasi asam asetat yang mencakup kesetaraan titik (pH = 8,72).
Di sisi lain, metil merah tidak berguna dalam menentukan titik kesetaraan, karena ia berubah warna dalam interval pH 4,5 menjadi 6,4.
Referensi
- Helmestine, Anne Marie. Definisi titik kesetaraan. Pulih dari Thoughtco.com
- Perbedaan antara titik akhir dan titik kesetaraan. Diperoleh dari perbedaan antara.bersih
- Titik Kesetaraan: Definisi & Perhitungan. Studi pulih.com

