Apa itu Kinetika Kimia?

- 4879
- 1229
- Domingo Gutkowski
Kami menjelaskan apa itu kinetika kimia, kecepatan dan kecepatan reaksi, dan faktor -faktor yang mempengaruhi kecepatan
Apa itu Kinetika Kimia?
Itu Kinetika kimia Ini adalah cabang kimia yang bertanggung jawab untuk mempelajari kecepatan reaksi kimia, faktor -faktor apa yang mempengaruhi kecepatan ini dan apa mekanisme atau langkah -langkah individu yang melaluinya reaksi kimia terjadi.
Selain itu, memungkinkan kita untuk memahami banyak aspek reaksi kimia seperti keseimbangan kimia dan energi aktivasi, dan mempelajari proses katalisis. Yang terakhir membuatnya sangat penting dalam banyak aplikasi, dari biokimia hingga teknik industri.
Di tengah kinetika adalah kecepatan reaksi, yang dapat dipahami sebagai laju di mana reagen diubah menjadi produk. Namun, dalam kinetika kimia ada definisi yang jauh lebih tepat.
Definisi kecepatan reaksi
Untuk memberikan definisi lengkap dari kecepatan reaksi, seperti yang digunakan dalam kinetika kimia, mari kita mulai dengan reaksi kimia generik berikut:
Dalam reaksi ini, A dan B mewakili reagen, C dan D mewakili produk, sementara A, b, c Dan D Mereka mewakili koefisien stoikiometrik masing -masing.
Laju reaksi (diwakili dengan simbol v) Menunjukkan seberapa cepat. Secara matematis, ini dinyatakan sebagai berikut:
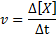
Di mana Δ [x] mewakili perubahan konsentrasi molar spesies x (a, b, c atau d) dalam interval waktu Δt.
Jelaslah bahwa semakin cepat reagen yang dikonsumsi, semakin cepat reagen lainnya akan dikonsumsi dan semakin cepat produk akan terjadi. Untuk alasan ini, hanya perlu untuk mendefinisikan kecepatan dalam hal salah satunya.
Itu dapat melayani Anda: metode pemisahan campuran homogenUntuk memastikan bahwa hasil perhitungan kecepatan selalu sama, terlepas dari spesies mana kecepatannya didefinisikan, ia harus selalu dibagi antara koefisien stoikiometrik dan menempatkan tanda lebih sedikit sebelum persamaan jika itu adalah reagen. Artinya:
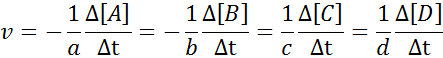
Contoh definisi kecepatan reaksi
Mengingat reaksi kimia berikut:
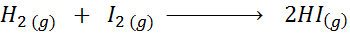
Tuliskan definisi kecepatan reaksi tergantung pada setiap spesies yang terlibat.
Larutan:
Dalam hal h2:
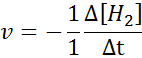
Dalam hal i2:
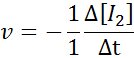
Dalam hal HI:
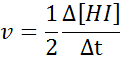
Hukum kecepatan dan urutan reaksi
Reaksi terjadi ketika atom dan molekul bertabrakan satu sama lain dengan energi yang cukup dan orientasi yang tepat. Probabilitas bahwa ini terjadi meningkat karena atom dan molekul lebih terkonsentrasi.
Untuk alasan ini, kecepatan hampir selalu tergantung pada konsentrasi reagen. Dalam beberapa kasus, kecepatan juga tergantung pada konsentrasi salah satu produk, serta konsentrasi katalis atau inhibitor apa pun yang ada di lingkungan.
Persamaan matematika yang menghubungkan kecepatan reaksi terhadap konsentrasi spesies berbeda yang terlibat disebut "Hukum Kecepatan”Dan, dalam kasus yang lebih sederhana, ia memiliki bentuk berikut:
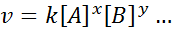
Di mana k Itu adalah konstanta proporsionalitas yang disebut Konstanta Kecepatan, dan eksponen A, B dan spesies lain yang muncul dalam persamaan, disebut Perintah reaksi.
Menurut jumlah semua urutan reaksi (yang disebut urutan global), berbagai jenis reaksi dapat dibedakan. Ini berbeda dari seberapa besar konsentrasi mempengaruhi kecepatan, dalam formula waktu yang diperlukan untuk mengonsumsi setengah dari reagen (setengah -kehidupan) dan dengan cara konsentrasi reagen berubah dari waktu ke waktu (grafik [a] vs t ).
-
Reaksi pesanan 0
Ketika semua eksponen dalam hukum kecepatan adalah 0, persamaan hukum kecepatan dikurangi menjadi:
Dapat melayani Anda: tautan kovalen terkoordinasi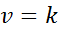
Dengan kata lain, mereka adalah reaksi yang terjadi pada kecepatan konstan dan di mana kecepatan tidak tergantung pada konsentrasi reagen atau produk apa pun.
Grafik pesanan 0
Grafik [a] vs t reaksi pesanan 0 adalah garis lurus yang menurun.
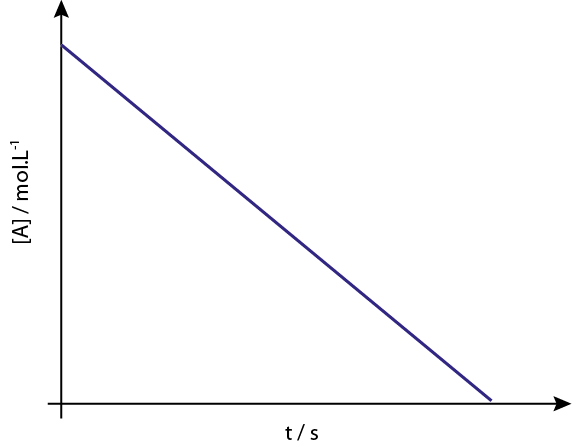
Legenda: Grafik konsentrasi vs waktu reaksi urutan 0 memberikan garis lurus.
Middle Life for Order 0
Untuk reaksi pesanan 0, waktu setengah -kehidupan (T1/2) Diberikan oleh:
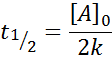
-
Reaksi pesanan pertama
Dalam reaksi ini, kecepatannya bervariasi secara linear dengan konsentrasi. Hukum kecepatan pesanan pertama adalah:
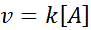
Grafik pesanan pertama
Grafik [a] vs t dari reaksi orde pertama adalah hiperbolas yang menurun. Namun, jika logaritma konsentrasi Neperian (ln [a]) vs waktu adalah grafik, garis lurus diperoleh.
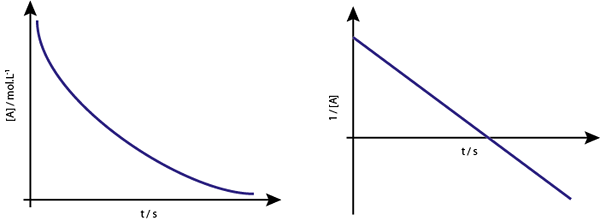 Grafik konsentrasi vs waktu reaksi urutan 1 memberikan hiperbola, tetapi grafik logaritma Neperian dari konsentrasi vs waktu memberikan garis
Grafik konsentrasi vs waktu reaksi urutan 1 memberikan hiperbola, tetapi grafik logaritma Neperian dari konsentrasi vs waktu memberikan garis Kehidupan tengah untuk reaksi urutan pertama
Untuk reaksi urutan 1, T1/2 Itu tidak tergantung pada konsentrasi awal dan diberikan oleh:
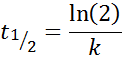
-
Reaksi urutan kedua
Reaksi bisa menjadi urutan kedua sehubungan dengan reagen tunggal, atau urutan pertama sehubungan dengan dua reagen. Dalam kasus pertama, hukum kecepatan diberikan oleh:
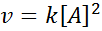
Grafik pesanan kedua
Grafik [a] vs t dari reaksi urutan kedua adalah hiperbolas yang menurun. Namun, jika kebalikan dari konsentrasi (1/[a]) vs waktu diplot, garis lurus diperoleh.
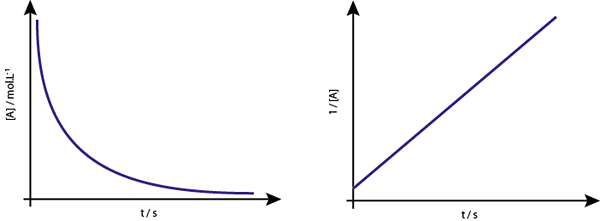 Grafik konsentrasi vs waktu reaksi urutan 2 memberikan kurva yang mirip dengan hiperbola menurun, tetapi grafik konsentrasi vs waktu memberikan garis
Grafik konsentrasi vs waktu reaksi urutan 2 memberikan kurva yang mirip dengan hiperbola menurun, tetapi grafik konsentrasi vs waktu memberikan garis Kehidupan tengah untuk reaksi orde kedua
Untuk reaksi pesanan 2, T1/2 Diberikan oleh:
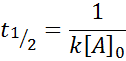
Faktor yang mempengaruhi kecepatan reaksi
Suhu
Suhu selalu meningkatkan kecepatan reaksi terjadi, karena frekuensi dan energi yang dengannya molekul bertabrakan satu sama lain meningkat. Ketergantungan pada kecepatan reaksi dengan suhu diberikan oleh persamaan arrhenius.
Itu dapat melayani Anda: magnesium hidrida: struktur, sifat dan penggunaanTekanan
Peningkatan tekanan setara dengan meningkatkan konsentrasi semua spesies dalam media reaksi (untuk reaksi fase gas), sehingga peningkatan tekanan cenderung meningkatkan kecepatan reaksi.
Katalis
Katalis adalah zat kimia yang ditambahkan ke media hanya untuk meningkatkan kecepatan reaksi. Sebagian besar katalis bekerja dengan mengubah mekanisme reaksi dengan yang membutuhkan energi aktivasi yang lebih rendah.
Contoh katalis umum adalah enzim dalam sistem kehidupan dan beberapa logam seperti platinum dan paladium.
Inhibitor
Inhibitor adalah kebalikan dari katalis. Mereka adalah zat yang membuat reaksi lebih lambat. Anti -korosif adalah contoh inhibitor yang berupaya mengurangi kecepatan reaksi korosi, untuk membuat permukaan logam lebih banyak.


