Apa anoda dan katoda?

- 4840
- 1176
- Irvin Reichel
Dia anoda dan katoda Mereka adalah jenis elektroda yang ditemukan dalam sel elektrokimia. Ini adalah perangkat yang mampu menghasilkan listrik melalui reaksi kimia. Sel elektrokimia yang paling banyak digunakan adalah baterai.
Ada dua jenis sel elektrokimia, sel elektrolitik dan sel galvanik atau volta. Dalam sel elektrolitik, reaksi kimia yang dihasilkan oleh energi tidak terjadi secara spontan, tetapi arus listrik diubah menjadi reaksi oksidasi kimia.

Sel galvanik terdiri dari dua semi -lodgs. Ini dihubungkan oleh dua elemen, pengemudi logam dan jembatan garam.
Konduktor listrik, seperti yang ditunjukkan oleh namanya, memimpin listrik karena ia memiliki sedikit ketahanan terhadap pergerakan muatan listrik. Driver terbaik biasanya logam.
Jembatan saline adalah tabung yang menghubungkan dua semi -lad, sambil mempertahankan kontak listrik mereka, dan tanpa membiarkan komponen dari setiap sel bergabung.Setiap semi -media sel galvanik mengandung elektroda dan elektrolit.
Ketika reaksi kimia terjadi, salah satu semi -lad kehilangan elektron ke elektroda, melalui proses oksidasi; Sementara yang lain memenangkan elektron untuk elektroda, melalui proses reduksi.
Proses oksidasi diproduksi dalam anoda, dan proses reduksi dalam katoda
[TOC]
Anoda
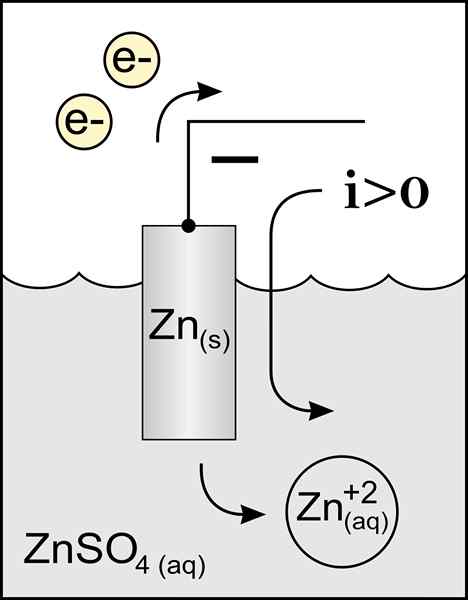 Diagram anoda seng dalam sel volta. Sumber: Pekerjaan Asli: File: Zinc Anode 2.PNG oleh Pengguna: Micheljullian (Talk) Pekerjaan Derivatif: Kes47/CC BY-S (http: // CreativeCommons.Org/lisensi/by-sa/3.0/)
Diagram anoda seng dalam sel volta. Sumber: Pekerjaan Asli: File: Zinc Anode 2.PNG oleh Pengguna: Micheljullian (Talk) Pekerjaan Derivatif: Kes47/CC BY-S (http: // CreativeCommons.Org/lisensi/by-sa/3.0/) Nama anoda berasal dari bahasa Yunani ανά (aná): Up, dan οδός (Odós): Path. Faraday adalah orang yang menciptakan istilah ini di abad kesembilan belas.
Anoda yang mendefinisikan terbaik adalah elektroda yang kehilangan elektron dalam reaksi oksidasi. Biasanya itu terkait dengan kutub positif transit arus listrik, tetapi tidak selalu terjadi.
Dapat melayani Anda: solusi yang dihargaiMeskipun dalam baterai anoda adalah kutub positif, di lampu LED itu sebaliknya, anoda menjadi kutub negatif.
Biasanya rasa arus listrik didefinisikan, menghargai itu sebagai rasa beban bebas, tetapi jika pengemudi tidak logam, muatan positif yang dihasilkan ditransfer ke driver eksternal.
Gerakan ini menyiratkan bahwa kami memiliki muatan positif dan negatif yang bergerak dalam indera yang berlawanan, sehingga dikatakan bahwa arah arus adalah rute muatan positif kation yang ada di anoda menuju beban negatif dari anoda dari anoda yang ditemukan di katoda.
Dalam sel galvanik, memiliki konduktor logam, arus yang dihasilkan dalam reaksi memang mengikuti jalur dari kutub positif ke negatif.
Tetapi dalam sel elektrolitik, tidak memiliki konduktor logam, tetapi elektrolit, ion dengan beban positif dan negatif yang bergerak dalam indera yang berlawanan dapat ditemukan.
Anoda termoionik menerima sebagian besar elektron yang berasal dari katoda, panaskan anoda dan harus menemukan cara untuk menghilang. Panas ini dihasilkan dalam tegangan yang terjadi antara elektron.
Anoda Khusus
Ada jenis anoda khusus, seperti yang ada di dalam x -rays. Dalam tabung ini, energi yang dihasilkan oleh elektron, selain menghasilkan x -rays, menghasilkan energi besar yang memanaskan anoda.
Panas ini terjadi pada tegangan yang berbeda antara kedua elektroda dan yang memberikan tekanan pada elektron. Saat elektron bergerak dalam arus listrik, mereka menabrak anoda dengan mentransmisikan panasnya.
Dapat melayani Anda: Persamaan Henderson-Haselbalch: Penjelasan, Contoh, LatihanKatoda
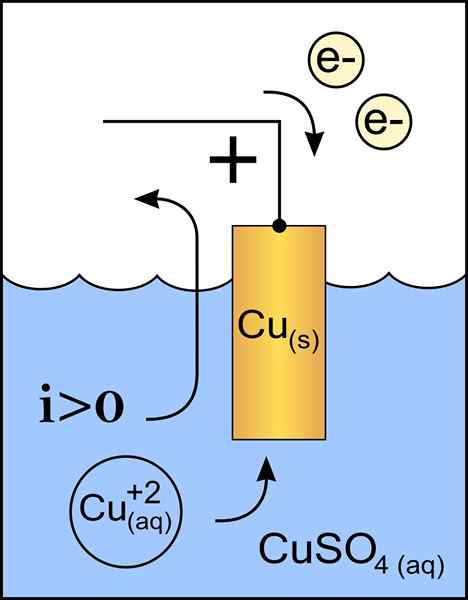 Diagram katoda tembaga dalam sel volta. Sumber: Pekerjaan Asli: File: Zinc Anode 2.PNG oleh Pengguna: Micheljullian (Talk) Pekerjaan Derivatif: Kes47/CC BY-S (http: // CreativeCommons.Org/lisensi/by-sa/3.0/)
Diagram katoda tembaga dalam sel volta. Sumber: Pekerjaan Asli: File: Zinc Anode 2.PNG oleh Pengguna: Micheljullian (Talk) Pekerjaan Derivatif: Kes47/CC BY-S (http: // CreativeCommons.Org/lisensi/by-sa/3.0/) Katoda adalah elektroda dengan beban negatif, yang dalam reaksi kimia mengalami reaksi reduksi, di mana status oksidasi berkurang ketika menerima elektron.
Seperti halnya anoda, Faraday -lah yang menyarankan istilah katoda yang berasal dari κατ warga Yunani [Catá]: 'turun', dan ὁΔός [odós]: 'jalan'. Untuk elektroda ini, beban negatif dikaitkan dari waktu ke waktu.
Pendekatan ini salah, karena tergantung pada perangkat di mana ia berada, ia memiliki beban atau lainnya.
Hubungan ini dengan kutub negatif, seperti dengan anoda, muncul dari asumsi bahwa arus mengalir dari kutub positif ke negatif. Ini muncul di dalam sel galvanik.
Di dalam sel elektrolitik, alat transfer energi, karena tidak ada dalam logam tetapi dalam elektrolit, dapat hidup berdampingan ion negatif dan positif yang bergerak dalam indera yang berlawanan. Namun dengan persetujuan, dikatakan bahwa arus beralih dari anoda ke katoda.
Katode Khusus
Jenis katoda spesifik adalah katoda termionik. Dalam hal ini, katoda memancarkan elektron karena efek panas.
Dalam katup termionik, katoda dapat memanaskan dirinya dengan mengedarkan arus pemanas dalam filamen yang telah digabungkan ke sana.
Reaksi keseimbangan
Jika kita mengambil sel galvanik, yang merupakan sel elektrokimia yang paling umum, kita dapat merumuskan reaksi kesetimbangan yang dihasilkan.
Setiap semi -media yang membentuk sel galvanik, memiliki ketegangan karakteristik yang dikenal sebagai potensi reduksi. Di dalam setiap semi -media ada reaksi oksidasi antara ion yang berbeda.
Dapat melayani Anda: spektrum penyerapanSaat reaksi ini mencapai keseimbangan, sel tidak dapat memberikan lebih banyak ketegangan. Pada saat ini, oksidasi yang terjadi di semi -media saat itu akan memiliki nilai positif yang lebih dekat adalah keseimbangan. Potensi reaksi akan lebih besar, semakin banyak keseimbangan yang tercapai.
Saat anoda seimbang, itu mulai kehilangan elektron yang melewati pengemudi ke katoda.
Dalam katoda, reaksi reduksi sedang terjadi, semakin jauh keseimbangan yang paling potensial akan memiliki reaksi saat memproduksi dan mengambil elektron yang berasal dari anoda.
Referensi
- Huheey, James dan., et al.Kimia Anorganik: Prinsip Struktur dan Reaktivitas. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, a.Kimia: Prinsip dan Properti. New York, AS: McGraw-Hill, 1966.
- Brady, James dan.Kimia Umum: Prinsip dan Struktur. Wiley, 1990.
- Petrucci, Ralph H., et al.Kimia Umum. Dana Pendidikan Inter -American, 1977.
- Masterton, William L.; Hurley, Cecile N.Kimia: Prinsip dan Reaksionen. Pembelajaran Cengage, 2015.
- Charlot, Gaston; Tremillon, Bernard; Badoz-Lambling, J. Reaksi elektrokimia. Toray-Masson, 1969.

