Reaksi endergonik

- 4268
- 741
- Dewey Runolfsdottir
 Reaksi akhir adalah non -spontan dan itu membutuhkan banyak energi
Reaksi akhir adalah non -spontan dan itu membutuhkan banyak energi Apa itu reaksi akhir?
A Reaksi endergonik Itu adalah salah satu yang tidak spontan, dan juga membutuhkan pasokan energi tinggi. Dalam kimia, energi ini biasanya kalori. Yang paling terkenal di antara semua reaksi endotermik adalah reaksi endotermik, yaitu, yang menyerap panas terjadi.
Alasan mengapa tidak semua reaksi spontan adalah karena mereka mengonsumsi energi, dan sistem yang dibentuk oleh spesies yang terlibat mengurangi entropi mereka. Dengan kata lain, untuk tujuan kimia, mereka menjadi lebih molekuler.
Membangun dinding bata adalah contoh dari reaksi akhir. Batu bata saja tidak cukup ringkas untuk membentuk tubuh yang kokoh. Ini karena tidak ada gain energi yang mempromosikan penyatuannya (juga tercermin dalam kemungkinan interaksi antarmolekul rendah).
Untuk membangun dinding, Anda membutuhkan semen dan tenaga kerja. Ini adalah energi, dan reaksi non -spontan (dinding tidak akan dibangun secara otomatis) menjadi mungkin jika manfaat energi dirasakan (ekonomi, dalam kasus dinding).
Jika tidak ada manfaatnya, dinding akan runtuh pada gangguan apa pun, dan batu bata mereka tidak akan pernah bisa tetap bersatu. Hal yang sama berlaku untuk banyak senyawa kimia, yang blok konstruksinya tidak dapat bergabung secara spontan.
Karakteristik reaksi akhir
- Itu tidak spontan.
- Menyerap panas (atau jenis energi lainnya).
Alasannya adalah bahwa produk mereka memiliki lebih banyak energi daripada reagen yang terlibat dalam reaksi. Di atas dapat diwakili dengan persamaan berikut:
ΔG = gProduk-GReagen
Di mana ΔG adalah perubahan energi bebas gibbs. Sebagai gProduk lebih besar (karena lebih energik) daripada gReagen, Pengurangan harus lebih besar dari nol (ΔG> 0). Gambar berikut merangkum yang baru dijelaskan:
Dapat melayani Anda: natrium sulfat (na2so4): struktur, sifat, penggunaan, mendapatkan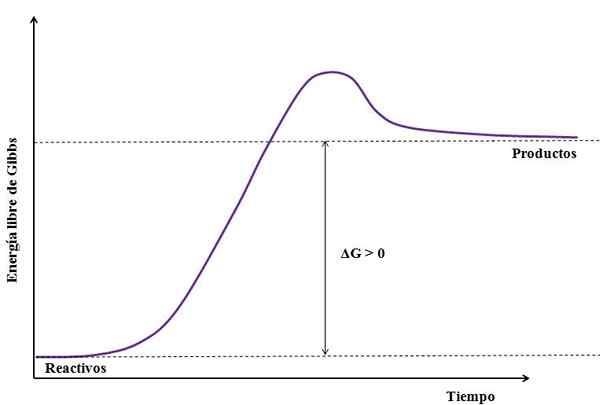 Sosok reaksi endergonik. Sumber: Gabriel Bolívar
Sosok reaksi endergonik. Sumber: Gabriel Bolívar Perhatikan perbedaan antara keadaan energi antara produk dan reagen (garis ungu). Oleh karena itu, reagen tidak berubah menjadi produk (a+b => c) jika tidak ada penyerapan panas terlebih dahulu.
Tingkatkan Energi Energi Gratis
Setiap reaksi endergonik memiliki peningkatan energi bebas sistem sistem. Jika untuk reaksi tertentu dipenuhi bahwa ΔG> 0, maka itu tidak akan spontan dan akan membutuhkan pasokan energi untuk dilakukan.
Bagaimana mengetahui secara matematis apakah reaksi itu endegonik atau tidak? Menerapkan persamaan berikut:
ΔG = ΔH-tΔS
Di mana ΔH adalah entalpi reaksi, yaitu, total energi yang dilepaskan atau diserap, ΔS adalah perubahan entropi, dan t suhu. Faktor TΔS adalah hilangnya energi yang tidak dieksploitasi dalam ekspansi atau pemesanan molekul dalam suatu fase (padat, cair atau soda).
Dengan demikian, ΔG adalah energi yang dapat digunakan sistem untuk melakukan pekerjaan. Karena ΔG memiliki tanda positif untuk reaksi akhir, energi atau pekerjaan (reagen) harus diterapkan untuk mendapatkan produk.
Jadi, mengetahui nilai ΔH (positif, untuk reaksi endotermik, dan negatif, untuk reaksi eksotermik), dan TΔS, Anda dapat mengetahui apakah reaksi adalah akhir -gononik.
Ini berarti bahwa, meskipun reaksi adalah endotermik, TIDAK Itu tentu endogonik.
Ice Cube
Misalnya, es batu meleleh dalam air cair yang menyerap panas, yang membantu memisahkan molekulnya; Namun, prosesnya spontan dan, oleh karena itu, itu bukan reaksi akhir.
Dalam hal ICE didirikan pada suhu jauh di bawah -100 ° C, istilah TΔS dari persamaan energi bebas menjadi kecil dibandingkan dengan ΔH (karena T berkurang), dan sebagai hasilnya, ΔG akan memiliki nilai positif.
Dapat melayani Anda: asam karboksilatDengan kata lain: Lelehkan es di bawah -100 ° C adalah proses endegonik, dan tidak spontan. Kasing serupa adalah membekukan air sekitar 50 ° C, yang tidak terjadi secara spontan.
Tautan produk mereka lebih lemah
Fitur penting lainnya, juga terkait dengan ΔG, adalah energi dari tautan baru. Tautan produk yang terbentuk lebih lemah daripada reagen.
Namun, penurunan kekuatan tautan dikompensasi dengan gain massa, yang tercermin dalam sifat fisik.
Di sini perbandingan dengan dinding bata mulai kehilangan makna. Menurut yang di atas, jeruji di dalam batu bata harus lebih kuat dari yang ada di antara mereka dan semen. Namun, dinding secara keseluruhan lebih kaku dan tahan untuk memiliki massa yang lebih besar.
Itu digabungkan dengan reaksi eksergonik
Jika reaksi akhir -spontan tidak spontan, bagaimana mereka terjadi di alam? Jawabannya adalah karena penggabungan dengan reaksi lain yang cukup spontan (exergonic) dan entah bagaimana mempromosikan perkembangan mereka.
Misalnya, persamaan kimia berikut mewakili poin ini:
A + b => c (reaksi endergonik)
C + d => e (reaksi eksergonik)
Reaksi pertama tidak spontan, jadi secara alami itu tidak bisa terjadi. Namun, produksi C memungkinkan reaksi kedua terjadi, menyebabkan dan.
Menambahkan energi gratis Gibbs untuk dua reaksi, ΔG1 dan ΔG2, Dengan hasil kurang dari nol (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Itu bisa melayani Anda: hidrorsJika C tidak bereaksi dengan D, saya tidak akan pernah bisa membentuknya, karena tidak memiliki kompensasi energi (seperti kasus uang dengan dinding bata). Kemudian dikatakan bahwa c dan d "jalan" ke A dan B untuk bereaksi, bahkan menjadi reaksi endegonik.
Contoh reaksi endergonik
Fotosintesis
Tanaman menggunakan energi matahari untuk membuat karbohidrat dan oksigen dari karbon dioksida dan air. Co₂ dan o2, Molekul kecil dengan hubungan yang kuat, membentuk gula, dari struktur tarry, yang lebih berat, padat, dan meleleh pada suhu sekitar 186º C.
Perhatikan bahwa tautan C-C, C-H dan C-O lebih lemah daripada O = C = O dan O = O. Dan dari unit gula, tanaman dapat mensintesis polisakarida, seperti selulosa.
Sintesis biomolekul dan makromolekul
Reaksi endermanik adalah bagian dari proses anabolik. Seperti karbohidrat, biomolekul lain, seperti protein, dan lipid, membutuhkan mekanisme kompleks yang tanpa mereka, dan digabungkan dengan reaksi hidrolisis ATP, tidak mungkin ada.
Pembentukan berlian dan senyawa kasar mentah
Berlian membutuhkan tekanan dan suhu yang sangat besar, sehingga komponennya dapat padat dalam padatan kristal.
Namun, beberapa kristalisasi spontan, meskipun lewat kecepatan yang sangat lambat (spontanitas tidak terkait dengan kinetika reaksi).
Akhirnya, minyak mentah saja mewakili produk reaksi endergonik, terutama hidrokarbon berat atau makromolekul yang disebut aspalten.
Struktur mereka sangat kompleks, dan sintesis mereka membutuhkan banyak waktu (jutaan tahun), aksi panas dan bakteri.
Contoh lainnya
- Napas Tanaman Seluler.
- Pengangkutan oksigen dalam aliran darah.
- Difusi ion melalui membran sel.
- Kontraksi otot.
- Sintesis protein sel.
Referensi
- Reaksi endermanik dan exeronic. Pulih dari quimitube.com
- Energi bebas. Pulih dari es.Khanacademy.org
- Definisi reaksi endergonik. Diperoleh dari biologi.bersih

