Reaksi eksotermik dan endotermik
- 2004
- 611
- Miss Marion Graham
 Pembakaran adalah contoh reaksi eksotermik, karena melepaskan panas. Untuk bagiannya, es meleleh melalui reaksi endotermik, karena membutuhkan energi termal
Pembakaran adalah contoh reaksi eksotermik, karena melepaskan panas. Untuk bagiannya, es meleleh melalui reaksi endotermik, karena membutuhkan energi termal Itu reaksi eksotermik dan endotermik Mereka berbeda dalam fakta bahwa energi termal pelepasan pertama, sedangkan yang terakhir menyerapnya, sesuai dengan perubahan panas yang terjadi selama reaksi kimia.
Demikian pula, jenis energi lain dapat terlibat dalam reaksi kimia, karena kadang -kadang selama reaksi, energi cahaya, energi suara dan bahkan listrik diproduksi.
Untuk memperhitungkan tidak hanya panas, tetapi jenis energi lainnya, reaksi kimia diklasifikasikan sebagai Exergonic Dan Endermanics. Reaksi eksergonik melepaskan energi saat diproduksi, sementara endegonik menyerapnya.
Dalam hal ini, reaksi eksotermik juga merupakan reaksi eksergonik, karena melepaskan panas. Salah satu contoh yang paling akrab adalah pembakaran. Setiap kali sepotong kayu terbakar, kalori dan energi cerah dilepaskan.
Di sisi lain, salah satu reaksi kimia endergi paling terkenal terjadi saat melelehkan es batu, karena es menyerap energi termal lingkungan untuk berubah menjadi air cair.
Reaksi eksotermik dapat terjadi secara spontan, meskipun kadang -kadang Anda perlu melakukan beberapa pekerjaan untuk memulai. Namun, untuk terjadi reaksi endotermik, selalu perlu bagi lingkungan untuk melakukan pekerjaan pada sistem.
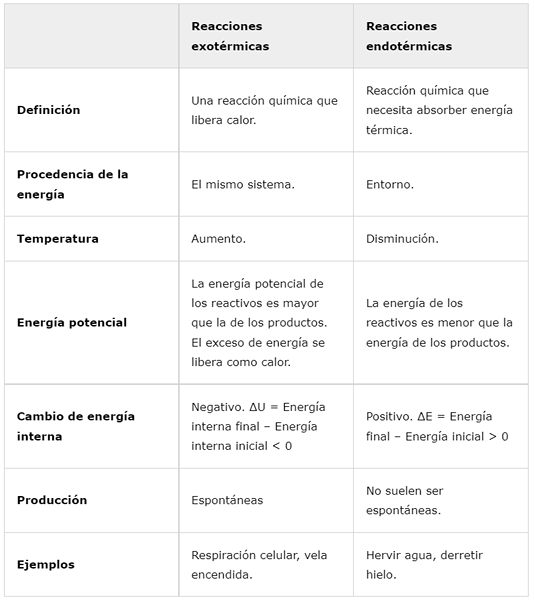
Reaksi eksotermik | Reaksi endotermik | |
Definisi | Reaksi kimia yang melepaskan panas. | Reaksi kimia yang perlu menyerap energi termal. |
Asal energi | Sistem yang sama. | Sekitar. |
Suhu | Meningkatkan. | Mengurangi. |
Energi potensial | Energi potensial reagen lebih besar dari produk. Kelebihan energi dilepaskan sebagai panas. | Energi reagen kurang dari energi produk. |
Perubahan Energi Internal | Negatif. ΔU = energi internal akhir - energi internal awal < 0 | Positif. ΔE = Energi Akhir - Energi Awal> 0 |
Produksi | Spontan | Mereka biasanya tidak spontan. |
Contoh | Napas seluler, lilin terbakar. | Rebus air, leburkan es. |
Reaksi eksotermik
Definisi
Jenis reaksi kimia yang melepaskan panas saat dilakukan.
Itu dapat melayani Anda: cyclohexen: struktur, sifat, sintesis dan penggunaanAsal energi
Sistem yang sama menyediakan energi sehingga reaksi terjadi.
Suhu
Setelah reaksi ada a meningkatkan suhu.
Energi potensial
Ketika reaksi kimia terjadi antara reagen, tautan dipecah di antara mereka dan yang lainnya dibentuk untuk membuat molekul baru. Tetapi tidak semua tautan menyatukan atom dan molekul dengan gaya yang sama, oleh karena itu, energi untuk memecahkan atau membuat setiap tautan berbeda.
Selama setiap reaksi mereka merusak dan membuat jumlah tautan yang berbeda, jadi energi berbeda. Dalam reaksi eksotermik, energi potensial reagen lebih tua daripada produk, dan karena energinya dipertahankan, kelebihannya dilepaskan sebagai panas.
Perubahan Energi Internal
Energi internal terkait dengan kemampuan sistem untuk melakukan pekerjaan, dan mencakup energi potensial dan energi kinetiknya. Energi absolut dari sistem tidak ditentukan, tetapi variasinya, disebut ΔU.
Menurut apa yang dikatakan di bagian sebelumnya, perubahan energi internal ΔU adalah negatif.
ΔU = energi internal akhir - energi internal awal < 0
Produksi
Kebanyakan reaksi eksotermik adalah spontan, yaitu, mereka terjadi untuk diri mereka sendiri, tanpa perlu menambahkan energi eksternal, sampai reagen habis.
Contoh
Biasanya, reaksi oksidasi dan yang menyebabkan pembentukan senyawa biasanya merupakan reaksi eksotermik:
1. Larutkan deterjen dalam air
Saat melarutkan debu pakaian dalam sedikit air dingin, dia merasa hangat saat menyentuhnya.
2. Napas seluler
Pada hewan dan tumbuhan, proses respirasi seluler dilakukan sebagai bagian dari siklus karbon. Pernapasan menggunakan glukosa dan oksigen untuk mengembalikan karbon dioksida, air dan energi, sesuai dengan reaksinya:
Dapat melayani Anda: titanium oksida (iv): struktur, sifat, penggunaanC6H12SALAH SATU6 + 62 → 6co2 + H2O + energi (ATP)
3. Lilin yang terbakar
Selain cahaya, lilin yang terbakar mengeluarkan panas dan zat lainnya:
Oksigen oksigen → air + karbon dioksida + cahaya dan panas
4. Kumbang pemboman
Serangga ini membela diri dengan menaburkan aerosol tentang predatornya. Kumbang menjaga cairan dan enzim di kompartemen terpisah, terletak di perutnya.
Saat terancam, itu mengeluarkan cairan ke arah kompartemen enzim dan reaksi kimia yang menghasilkan uap dan panas diproduksi, bertindak sebagai penolak untuk predator yang mungkin terjadi.
5. Wol baja dan cuka
Besi seperti logam perlahan teroksidasi saat bereaksi dengan lingkungan, tetapi jika cuka ditambahkan ke wol baja kecil, diamati bahwa oksidasi jauh lebih cepat dan pada saat yang sama menghasilkan panas.
Reaksi endotermik
Definisi
Reaksi di mana reagen perlu menyerap energi termal sehingga produk diperoleh.
Asal energi
Energi yang diperlukan untuk reaksi dilakukan hasil dari lingkungan.
Suhu
Reaksi endotermik memerlukan a mengurangi suhu.
Energi potensial
Tidak seperti apa yang terjadi dengan reaksi eksotermik, energi reagen Itu kurang bahwa energi produk.
Perubahan Energi Internal
Dalam reaksi endotermik, perubahan energi internal ΔE adalah positif.
ΔE = Energi Akhir - Energi Awal> 0
Oleh karena itu, energi akhir lebih besar dari yang awal.
Produksi
Reaksi endotermal mengharuskan pekerjaan pada sistem dilakukan, jadi mereka biasanya tidak spontan.
Namun, ada beberapa reaksi endotermik, seperti pencairan es dan penguapan cairan tertentu, yang spontan pada suhu kamar.
Disimpulkan bahwa suhu lingkungan adalah faktor penentu dalam spontanitas reaksi kimia.
Itu dapat melayani Anda: Indikator Kimia: Untuk apa, jenisnya, contohContoh
Banyak reaksi yang melibatkan pembubaran garam dan, secara umum, dekomposisi zat, biasanya endotermik. Dengan cara yang sama, lewatnya es ke air cair, dan air cair uap, yaitu transformasi keadaan, juga merupakan reaksi endotermik.
1. Fotosintesis
Tanaman melakukan reaksi kimia di hadapan sinar matahari, di mana mereka mengubah karbon dioksida dan air menjadi glukosa dan oksigen. Klorofil adalah molekul utama dalam proses ini, yang reaksi kimianya adalah:
Cahaya + 6co2 + H2O → c6H12SALAH SATU6 + 62
Seperti yang dapat dilihat, itu adalah reaksi terbalik dari pernapasan. Untuk menghasilkan satu kilogram glukosa, 15 mega joule dari energi matahari diperlukan.
2. Rebus air dan masak
Reaksi yang sangat umum, yang membutuhkan energi untuk melanjutkan, adalah air mendidih:
H2O (cairan) + energi → h2O (uap)
Makanan biasanya membutuhkan air untuk memasak, dan dengan cara yang sama air yang dikandungnya harus menguap untuk memasaknya, yang melibatkan perubahan keadaan.
3. Untuk melelehkan es
Demikian pula, adalah umum untuk es untuk meleleh pada suhu kamar, jika ini lebih besar dari 0 ° C:
H2O (solid) + energi → h2O (cairan)
Oleh karena itu, minuman dingin saat menambahkan es, karena menyerap energi yang diperlukan untuk mengubah keadaan dari cairan.
4. Tas dingin
Mereka digunakan untuk mengobati memar dan pukulan. Mengandung air dan amplop dengan amonium klorida. Saat mengetuk tas, amplop rusak dan reaksi amonium klorida dengan air, yang bersifat endotermik, mendinginkan kantong dan menghilangkan rasa sakit.
5. Produksi ozon
Radiasi ultraviolet dari matahari mengubah oksigen menjadi ozon, melepaskan panas dalam prosesnya.
32 (Gas) + lampu ultraviolet → 2nd3 (gas)
Referensi
- BYJU. Perbedaan antara reaksi edotermik dan eksotermik. Pulih dari byjus.com
- Chang, R. (2013). Kimia. 11va. Edisi. Pendidikan Bukit McGraw.
- Grelane. Reaksi eksotermik terhadap sesuatu yang panas. Pulih dari: grelane.com.
- Hein, m. (2014). Yayasan Kimia Perguruan Tinggi. Wiley.
- Helmestine, a. Memahami reaksi endotermik dan eksotermik. Pulih dari: thinkco.com

