Karakteristik reaksi kimia, bagian, jenis, contoh

- 3714
- 593
- Jessie Harvey
Itu reaksi kimia Mereka adalah perubahan yang penting dalam pemesanan atom mereka, dan terjadi ketika dua zat atau senyawa berbeda bersentuhan. Dalam proses perubahan yang dapat dirasakan segera; seperti peningkatan suhu, pendinginan, pembentukan gas, kilat atau curah hujan padatan.
Reaksi kimia yang paling umum sering tidak diperhatikan dalam kehidupan sehari -hari; Ribuan dari mereka dilakukan di tubuh kita. Namun, yang lain lebih terlihat, karena kita dapat melakukannya di dapur dengan memilih peralatan dan bahan yang benar; Misalnya, campur bikarbonat dengan cuka, gula melter dalam air atau mengasamkan jus colorad.
 Reaksi bikarbonat dan cuka adalah contoh reaksi kimia berulang di dapur. Sumber: Kate ter har (https: // www.Flickr.com/foto/Katerha/5703151566)
Reaksi bikarbonat dan cuka adalah contoh reaksi kimia berulang di dapur. Sumber: Kate ter har (https: // www.Flickr.com/foto/Katerha/5703151566) Di laboratorium, reaksi kimia menjadi lebih biasa dan umum; Semua terjadi di dalam gelas (gelas), atau labu Erlenmeyer. Jika mereka berbagi kesamaan, tidak ada yang sederhana, karena mereka menyembunyikan tabrakan, jeda tautan, mekanisme, pembentukan tautan, energi dan aspek kinetik.
Ada reaksi kimia yang sangat mencolok sehingga penggemar dan ilmuwan, mengetahui toksikologi reagen dan beberapa langkah keamanan, mereproduksi mereka pada skala besar dalam tindakan demonstrasi yang menarik.
[TOC]
Konsep Reaksi Kimia
Reaksi kimia terjadi ketika ada pemecahan tautan (ionik atau kovalen), sehingga yang lain terbentuk di tempat; Dua atom atau satu set mereka berhenti berinteraksi dengan kuat untuk menyebabkan molekul baru. Berkat ini, sifat kimia suatu senyawa, reaktivitasnya, stabilitas, dengan apa yang bereaksi dapat ditentukan.
Selain bertanggung jawab atas reaksi kimia yang terus -menerus berubah, tanpa atom mereka, mereka menjelaskan munculnya senyawa seperti yang kita ketahui.
Agar tautan rusak, energi diperlukan, dan ketika tautan terbentuk, dilepaskan. Jika energi yang diserap lebih besar dari yang dilepaskan, dikatakan bahwa reaksinya adalah endotermal; Kami memiliki pendinginan di sekitarnya. Sementara jika panas yang dilepaskan lebih unggul daripada penyerap, maka itu akan menjadi reaksi eksotermik; Lingkungannya dipanaskan.
Karakteristik reaksi kimia
Kinetika
Teori molekul harus berkolaborasi satu sama lain, membawa serta energi kinetik yang cukup untuk mendukung pemecahan tautan. Jika tabrakan Anda lambat atau tidak efisien, reaksi kimianya dipengaruhi secara kinetik. Ini dapat terjadi baik dengan keadaan fisik zat, atau dengan geometri atau struktur yang sama.
Dengan demikian, dalam suatu reaksi materi ini diubah dengan menyerap atau melepaskan panas, sementara menderita tabrakan yang mendukung pembentukan produk; Komponen terpenting dari reaksi kimia apa pun.
Konservasi massal
Karena undang -undang konservasi massa, massa total set tetap konstan setelah reaksi kimia. Dengan demikian, jumlah massa individu dari masing -masing zat sama dengan massa hasil yang diperoleh.
Perubahan fisik dan/atau perubahan status
Terjadinya reaksi kimia dapat disertai dengan perubahan keadaan komponen; yaitu, variasi dalam keadaan bahan padat, cair atau gas.
Namun, tidak semua perubahan dalam keadaan menyiratkan reaksi kimia. Misalnya: Jika air menguap karena panas, uap air yang dihasilkan setelah perubahan keadaan ini tetap menjadi air.
Variasi warna
Di antara atribut fisik yang dihasilkan dari reaksi kimia, perubahan warna reagen versus warna produk akhir menonjol.
Fenomena ini cukup besar ketika mengamati reaksi kimia logam dengan oksigen: ketika logam dioksidasi, ia mengubah warna karakteristiknya (emas atau perak, seperti kasusnya), menjadi nada oranye-reddish, yang dikenal sebagai karat.
Pelepasan gas
Karakteristik ini dimanifestasikan sebagai gelembung atau dengan emisi bau tertentu.
Secara umum, gelembung muncul sebagai hasil dari pengajuan cairan pada suhu tinggi, yang mendorong peningkatan energi kinetik molekul yang merupakan bagian dari reaksi.
Perubahan Suhu
Jika panas adalah katalis dari reaksi kimia, perubahan suhu akan diinduksi dalam produk akhir. Oleh karena itu, masuknya panas dan keluar dalam proses juga dapat menjadi karakteristik reaksi kimia.
Bagian dari reaksi kimia
Reagen dan produk
Reaksi kimia apa pun diwakili oleh persamaan jenis:
A + B → C + D
Di mana a dan b adalah reaktan, sedangkan c dan d produk. Persamaan ini memberi tahu kita bahwa atom atau molekul A, bereaksi dengan B menyebabkan produk C dan D. Ini adalah reaksi yang tidak dapat diubah, karena reaktan tidak dapat berasal dari produk. Sebaliknya, reaksi di bawah ini dapat dibalik:
A + B C + D
Penting untuk menekankan bahwa massa reaktan (A+B) harus sama dengan massa produk (C+D). Kalau tidak, adonan tidak akan dilestarikan. Demikian juga, jumlah atom untuk elemen yang diberikan harus sama sebelum dan sesudah panah.
Di atas panah menunjukkan beberapa spesifikasi reaksi: suhu (δ), insiden radiasi ultraviolet (Hv), atau katalis yang digunakan.
Dapat melayani Anda: jam jamReaksi berarti
Berkenaan dengan kehidupan dan reaksi yang terjadi dalam tubuh kita, media reaksi berair (AC). Namun, reaksi kimia dapat dikembangkan dalam media cair apa pun (etanol, asam asetat glasial, toluena, tetrahydrofuran, dll.) Selama reagen dibubarkan dengan baik.
Wadah atau reaktor
Reaksi kimia terkontrol terjadi dalam wadah, baik itu bahan kaca sederhana, atau dalam reaktor stainless steel.
Jenis Reaksi Kimia
Jenis reaksi kimia didasarkan pada apa yang terjadi pada tingkat molekuler; Tautan apa yang rusak dan bagaimana atom akhirnya bergabung. Ini juga dipertimbangkan apakah spesies mendapatkan atau kehilangan elektron; Bahkan ketika ini terjadi di sebagian besar reaksi kimia.
Berikut adalah berbagai jenis reaksi kimia yang ada.
- Pengurangan oksidasi (Rédox)
Oksidasi tembaga
Dalam contoh patina, reaksi oksidasi terjadi: tembaga logam kehilangan elektron di hadapan oksigen untuk berubah menjadi oksida yang sesuai.
4cu + o2(g) => cu2Anda)
Tembaga oksida (I) terus teroksidasi untuk memberikan oksida tembaga (II):
2cu2Atau (s) + atau2 => 4cuo
Jenis reaksi kimia ini di mana spesies meningkatkan atau mengurangi jumlah oksidasi (atau status), dikenal sebagai reaksi oksidasi dan reduksi (Rédox).
Tembaga logam dengan keadaan oksidasi 0, pertama kehilangan elektron, dan kemudian yang kedua (teroksidasi), sedangkan oksigen tetap (dikurangi):
Cu => cu+ + Dan-
Cu+ => Cu2+ + Dan-
SALAH SATU2 + 2e- => 2nd2-
Keuntungan atau hilangnya elektron dapat ditentukan dengan menghitung angka oksidasi untuk atom dalam rumus kimia dari senyawa yang dihasilkan.
Untuk cu2Atau, diketahui bahwa karena itu adalah oksida, ia memiliki anion atau2-, Jadi untuk menjaga beban yang dinetralkan masing -masing dari dua atom tembaga harus memiliki +1 beban. Sangat mirip terjadi dengan cuo.
Tembaga ketika teroksidasi memperoleh bilangan oksidasi positif; dan oksigen, akan dikurangi, angka oksidasi negatif.
Besi dan kobalt
Contoh tambahan untuk reaksi ditunjukkan di bawah ini. Demikian juga, komentar singkat akan dibuat dan perubahan dalam nomor oksidasi akan ditentukan.
FECL2 + Cocl3 => FECL3 + Cocl2
Jika angka oksidasi dihitung, akan dicatat bahwa orang -orang dari CL tetap dengan nilai konstan -1; Tidak demikian, dengan iman dan rekan.
Sekilas, besi telah teroksidasi sementara kobalt telah berkurang. Bagaimana tahu? Karena besi berinteraksi sekarang tidak dengan dua CL- tetapi dengan tiga, menjadi atom klorin paling elektronegatif daripada besi dan kobalt. Di sisi lain, yang sebaliknya terjadi pada Cobalt: Mulai dari berinteraksi dengan tiga CL- untuk mereka berdua.
Jika alasan sebelumnya tidak jelas, persamaan kimia transfer bersih elektron ditulis:
Keyakinan2+ => Iman3+ + Dan-
Bersama3+ + Dan- => Co2+
Oleh karena itu iman2+ Itu teroksidasi, sedangkan co3+ berkurang.
Yodium dan mangan
6kmno4 + 5KI + 18HCL => 6MnCl2 + 5Kio3 + 6KCL+ 9H2SALAH SATU
Bahan kimia di atas mungkin tampak rumit, tetapi tidak. Klorin (cl-) bukan oksigen (atau2-) Pengalaman mendapatkan atau kehilangan elektron mereka. Yodium dan mangan, ya.
Mempertimbangkan hanya senyawa dengan yodium dan mangan yang Anda miliki:
Ki => kio3 (Nomor oksidasi: -1 hingga +5, kehilangan enam elektron)
Kmno4 => Mcl2 (Nomor oksidasi: +7 hingga +2, memenangkan lima elektron)
Yodium teroksidasi, sementara mangan berkurang. Bagaimana tahu tanpa menghitung? Karena yodium berubah dari menjadi kalium untuk berinteraksi dengan tiga oksigen (lebih elektronegatif); Dan sementara itu, kehilangan interaksi dengan oksigen dengan klorin (lebih sedikit elektronegatif).
Ki tidak bisa kehilangan enam elektron jika kmno4 Menang lima; Itulah sebabnya jumlah elektron harus diseimbangkan dalam persamaan:
5 (ki => kio3 + 6e-)
6 (kmno4 + 5e- => Mcl2)
Yang memunculkan transfer bersih 30 elektron.
Pembakaran
Pembakaran adalah oksidasi yang kuat dan energik di mana cahaya dan panas dilepaskan. Secara umum, dalam jenis reaksi kimia ini, oksigen berpartisipasi sebagai zat pengoksidasi atau komburaizing; Sedangkan agen pereduksi adalah bahan bakar, yang terbakar di akhir akun.
Di mana ada abu, ada pembakaran. Ini terdiri dari batubara dan oksida logam; Meskipun komposisinya secara logis tergantung pada apa bahan bakar itu. Di bawah ini adalah beberapa contoh:
C (S) + O2(g) => co2(G)
2co (g) + atau2(g) => 2co2(G)
C3H8(g) + 5o2(g) => 3co2(g) + 4h2O (g)
Masing -masing persamaan ini sesuai dengan pembakaran lengkap; yaitu, semua bahan bakar bereaksi dengan kelebihan oksigen untuk menjamin transformasi lengkapnya.
Perlu dicatat bahwa CO2 dan H2Atau mereka adalah produk mayoritas gas saat tubuh berkarbonasi terbakar (seperti kayu, hidrokarbon dan jaringan hewan). Tidak dapat dihindari bahwa beberapa batubara alotropik terbentuk, karena insufisiensi oksigen, serta gas yang kurang teroksigenasi seperti CO dan tidak.
- Perpaduan
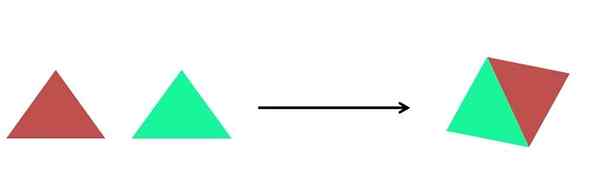
 Representasi grafis dari reaksi sintesis. Sumber: Gabriel Bolívar.
Representasi grafis dari reaksi sintesis. Sumber: Gabriel Bolívar. Dalam gambar superior representasi yang sangat sederhana ditampilkan. Setiap segitiga adalah senyawa atau atom, yang bersatu untuk membentuk senyawa tunggal; Dua segitiga membentuk jajaran genjang. Massa meningkat dan sifat fisik dan kimia produk, seringkali, sangat berbeda dari reagen mereka.
Dapat melayani Anda: entalpiMisalnya, pembakaran hidrogen (yang juga merupakan reaksi rédox), menghasilkan hidrogen oksida atau oksigen hidrida; lebih dikenal sebagai Agua:
H2(g) + atau2(g) => 2h2O (g)
Dengan mencampur kedua gas, pada suhu tinggi, membakar air gas. Suhu dingin, uap mengembun untuk memberikan air cair. Beberapa penulis menganggap reaksi sintesis ini sebagai salah satu alternatif yang mungkin untuk menggantikan bahan bakar fosil dalam mendapatkan energi.
H-H dan O = O Tautan rusak untuk membentuk dua tautan sederhana baru: h-o-h. Air, seperti yang diketahui, adalah zat yang tak tertandingi (di luar akal romantis), dan sifat -sifatnya sangat berbeda dari hidrogen dan oksigen gas.
Senyawa ionik
Pembentukan senyawa ionik dari unsur -unsurnya juga merupakan contoh reaksi sintesis. Salah satu yang paling sederhana adalah pembentukan halgenuros logam dari kelompok 1 dan 2. Misalnya, sintesis kalsium bromida:
CA (S) + BR2(L) => CABR2(S)
Persamaan umum untuk jenis sintesis ini adalah:
M (s) + x2 => Mx2(S)
Koordinasi
Ketika senyawa yang terbentuk melibatkan atom logam dalam geometri elektronik, dikatakan bahwa itu adalah kompleks. Di kompleks, logam tetap bersatu dengan ligan oleh ikatan kovalen yang lemah, dan dibentuk oleh reaksi koordinasi.
Misalnya, Anda memiliki kompleks [CR (NH3)6]3+. Ini terbentuk saat kation3+ berada di hadapan molekul amonia, NH3, yang bertindak sebagai ligan krom:
Cr3+ + 6nh3 => [CR (NH3)6]3+
Di bawah ini adalah koordinasi yang dihasilkan octahedron di sekitar pusat logam krom:
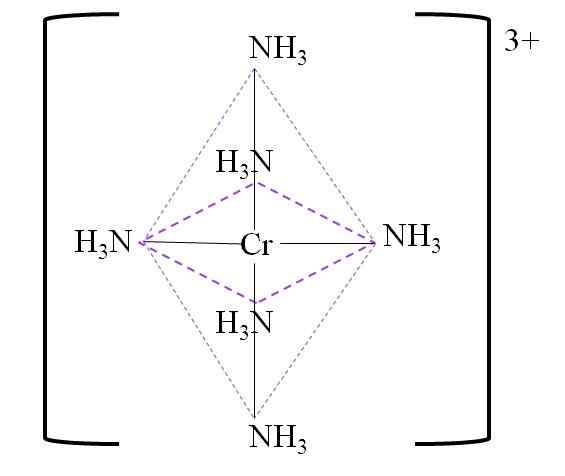 Octahedron koordinasi untuk kompleks. Sumber: Gabriel Bolívar.
Octahedron koordinasi untuk kompleks. Sumber: Gabriel Bolívar. Perhatikan bahwa beban kromium 3+ tidak dinetralkan di kompleks. Warnanya ungu, dan itulah sebabnya Octahedron diwakili dengan warna tersebut.
Beberapa kompleks lebih menarik, seperti dalam kasus enzim tertentu yang mengoordinasikan atom besi, seng dan kalsium.
- Penguraian
Dekomposisi menjadi kebalikan dari sintesis: senyawa memecah menjadi satu, dua atau tiga elemen atau senyawa.
Misalnya, ada tiga dekomposisi berikut:
2hgo (s) => 2hg (l) + o2(G)
2h2SALAH SATU2(L) => 2h2Atau (l) + o2(G)
H2BERSAMA3(ac) => co2(g) + h2Atau (l)
HGO adalah padatan kemerahan yang dengan aksi panas pecah menjadi merkuri logam, cairan hitam, dan oksigen.
Hidrogen hidrogen peroksida menderita dekomposisi, memberikan air cair dan oksigen.
Dan asam karbonat, sementara itu, terurai dalam karbon dioksida dan air cair.
Dekomposisi yang lebih "kering" adalah yang diderita karbonat logam:
Maling3(s) => cao (s) + co2(G)
Kelas Gunung Berapi
 Furniture Ammonium Dichromate Volcano. Sumber: наталия [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Furniture Ammonium Dichromate Volcano. Sumber: наталия [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Reaksi dekomposisi yang telah digunakan dalam kelas kimia adalah dekomposisi termal amonium dikromat, (NH4)2Cr2SALAH SATU7. Garam carcanogenal oranye ini (sehingga harus ditangani dengan sangat hati -hati), terbakar untuk melepaskan banyak panas dan menghasilkan padatan hijau, oksida krom, CR2SALAH SATU3:
(NH4)2Cr2SALAH SATU7(s) => cr2SALAH SATU3(S) + 4H2Atau (g) + n2(G)
- Pemindahan
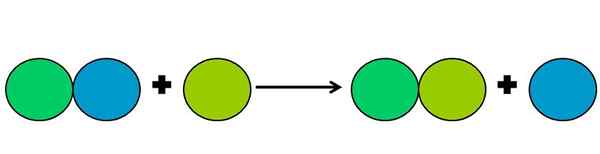 Representasi grafis dari reaksi perpindahan. Sumber: Gabriel Bolívar.
Representasi grafis dari reaksi perpindahan. Sumber: Gabriel Bolívar. Reaksi perpindahan adalah jenis reaksi rédox di mana satu elemen menggantikan yang lain dalam suatu senyawa. Elemen yang dipindahkan akhirnya mengurangi atau mendapatkan elektron.
Untuk menyederhanakan yang di atas, gambar atas ditampilkan. Lingkaran mewakili suatu elemen. Diamati bahwa Lima Green Circle menggantikan yang biru, berada di luar; Tetapi tidak hanya itu, tetapi lingkaran biru berkurang dalam prosesnya, dan lima hijau teroksidasi.
Hidrogen
Misalnya, persamaan kimia berikut untuk mengekspos yang di atas:
2al (s) + 6hcl (ac) => alcl3(AC) + 3H2(G)
Zr + 2h2Atau (g) => zro2(S) + 2H2(G)
Zn (s) + h2Sw4(ac) => znso4(Ac) + h2(G)
Apa elemen pengungsi untuk ketiga reaksi kimia ini? Hidrogen, yang direduksi menjadi hidrogen molekul, h2; melewati jumlah oksidasi +1 menjadi 0. Perhatikan bahwa logam aluminium, zirkonium dan seng dapat menggantikan hidrogen asam dan air; Saat tembaga, perak atau emas, tidak bisa.
Logam dan halogen
Demikian juga, dua reaksi perpindahan tambahan ini tersedia:
Zn (s) + cuo4(ac) => cu (s) + znso4(AC)
Cl2(g) + 2nai (ac) => 2nacl (ac) + i2(S)
Dalam reaksi pertama seng menggusur tembaga logam yang kurang aktif; Seng teroksidasi saat tembaga berkurang.
Di reaksi kedua, di sisi lain, klorin, elemen yang lebih reaktif daripada yodium, menggeser yang terakhir dalam garam natrium. Di sini terjadi ke belakang: elemen paling reaktif dikurangi dengan mengoksidasi elemen yang dipindahkan; Oleh karena itu, klorin berkurang teroksidasi menjadi yodium.
- Pembentukan gas
Dalam reaksi dapat dilihat bahwa beberapa di antaranya menghasilkan gas, dan oleh karena itu, mereka juga memasuki jenis reaksi kimia ini. Demikian juga, reaksi bagian sebelumnya, perpindahan hidrogen oleh logam aktif, dianggap sebagai reaksi pembentukan gas.
Dapat melayani Anda: dodecil natrium sulfate (SDS): struktur, sifat, penggunaanSelain yang sudah disebutkan, logam sulfida, misalnya, lepaskan hidrogen sulfida (yang berbau telur busuk) ketika asam klorida ditambahkan:
Na2S (s) + 2hcl (ac) => 2nacl (ac) + h2S (g)
- Metahesis atau perpindahan ganda
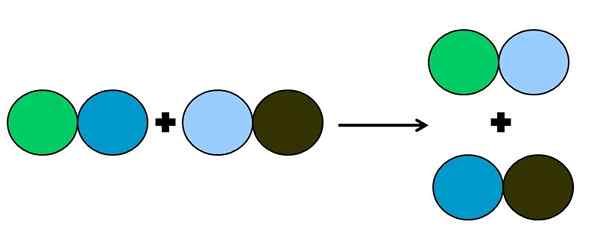 Representasi grafis dari reaksi perpindahan ganda. Sumber: Gabriel Bolívar.
Representasi grafis dari reaksi perpindahan ganda. Sumber: Gabriel Bolívar. Dalam reaksi metathesis atau perpindahan ganda, yang terjadi adalah perubahan pasangan tanpa transfer elektron; Artinya, itu tidak dianggap sebagai reaksi Rédox. Seperti yang dapat dilihat pada gambar superior, lingkaran hijau memecahkan tautan dengan warna biru tua untuk terhubung ke lingkaran biru muda.
Pengendapan
Ketika interaksi salah satu pasangan cukup kuat untuk mengatasi efek solverasi cairan, endapan diperoleh. Persamaan kimia berikut mewakili reaksi curah hujan:
Agno3(ac) + naCl (ac) => agcl (s) + nano3(AC)
CACL2(Ac) + na2BERSAMA3(ac) => caco3(s) + 2nacl (ac)
Dalam reaksi pertama CL- menggantikan no3- Untuk membentuk perak klorida, agcl, yang merupakan endapan putih. Dan dalam reaksi kedua, CO32- menggusur cl- Untuk mengendapkan kalsium karbonat.
Asam basa
Mungkin reaksi metathanesis yang paling lambang adalah asam basa netralisasi. Akhirnya, dua reaksi asam basa ditunjukkan sebagai contoh:
HCl (AC) + NaOH (AC) => NaCl (AC) + H2Atau (l)
2hcl (ac) + ba (OH)2(Ac) => bacl2(Ac) + 2h2Atau (l)
OH- Mereka pindah ke CL- Untuk membentuk air dan garam klorida.
Contoh reaksi kimia
Di bawah dan kemudian akan menyebutkan beberapa reaksi kimia dengan persamaan dan komentar masing -masing.
Pemindahan
Zn (S) + Agno3(AC) → 2AG (S) + Zn (Tidak3)2(AC)
Seng menggusur perak dalam garam nitratnya: itu mengurangi AG+ A Ag. Akibatnya, perak logam mulai mengendap di tengah, diamati pada mikroskop yang pohon bebas perak. Di sisi lain, nitrat dikombinasikan dengan ion Zn2+ dihasilkan membentuk seng nitrat.
Penetralan
Maling3(S) + 2HCL (AC) → CACL2(Ac) + h2Atau (l) + co2(G)
Asam klorida menetralkan garam kalsium karbonat untuk menghasilkan garam, kalsium klorida, air dan karbon dioksida. CO2 gelembung dan terdeteksi di dalam air. Bubb ini3.
NH3(g) + HCl (g) → NH4Cl (S)
Dalam reaksi kedua ini, uap HCl menetralkan amonia gas. Garam amonium klorida, NH4Cl, terbentuk seperti asap keputihan (gambar bawah), karena mengandung partikel yang sangat halus tersuspensi di udara.
 Reaksi pelatihan amonium klorida. Sumber: Adam Rędzikowski [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Reaksi pelatihan amonium klorida. Sumber: Adam Rędzikowski [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Perpindahan ganda
Agno3(AC) + NaCl (AC) → AgCl (S) + Nano3(AC)
Dalam reaksi perpindahan ganda ada pertukaran "pasangan". Perak mengubah pasangan dengan natrium. Hasilnya adalah garam baru, perak klorida, agcl, endapan seperti padatan susu.
Rédox
 Dalam reaksi kimia yang menggonggong panas anjing, cahaya dan cahaya biru dilepaskan. Sumber: Maxim Bilovitskiy via Wikipedia.
Dalam reaksi kimia yang menggonggong panas anjing, cahaya dan cahaya biru dilepaskan. Sumber: Maxim Bilovitskiy via Wikipedia. Ada reaksi yang tak terhitung banyaknya Rédox. Salah satu yang paling mengesankan adalah Barkin Dog:
8 n2Atau (g) + 4 cs2(L) → S8(s) + 4 co2(g) + 8 n2(G)
Energi yang dilepaskan sangat banyak ketika tiga produk stabil terbentuk, sehingga flash kebiruan (gambar superior) dan peningkatan tekanan yang disebabkan oleh gas yang berasal (CO2 dan N2).
Dan selain itu, semua ini disertai dengan suara yang sangat kuat yang mirip dengan gonggongan seekor anjing. Belerang diproduksi, s8, Tutupi kuning dinding internal tabung.
Spesies mana yang dikurangi dan mana yang teroksidasi? Sebagai aturan umum, elemen memiliki nomor oksidasi 0. Oleh karena itu, sulfur dan nitrogen dalam produk harus spesies yang mendapatkan atau kehilangan elektron.
Sulfur teroksidasi (elektron yang hilang), karena memiliki nomor oksidasi -2 di CS2 (C4+S22-):
S2- → s0 + 2e-
Sementara nitrogen dikurangi (dimenangkan elektron), karena memiliki nomor oksidasi +1 di n2Atau (n2+SALAH SATU2-):
2n+ + 2e → n0
Latihan reaksi kimia terpecahkan
- Latihan 1
Garam apa yang mengendap dalam reaksi berikutnya dalam media berair?
Na2S (ac) + feso4(AC) →?
Sebagai aturan umum, semua sulfida, kecuali untuk dibentuk dengan logam alkali dan amonium, endapan dalam media berair. Perpindahan ganda terjadi: besi berikatan dengan sulfida, dan natrium dengan sulfat:
Na2S (ac) + feso4(ac) → fes (s) + na2Sw4(AC)
- Latihan 2
Produk apa yang akan kita dapatkan dari reaksi berikut?
Stempel3)2 + CA (OH)2 →?
Kalsium hidroksida tidak terlalu larut dalam air; Tetapi penambahan tembaga nitrat membantu melarutkannya karena bereaksi membentuk hidroksida yang sesuai:
Stempel3)2(AC) + CA (OH)2(AC) → Cu (OH)2(s) + ca (tidak3)2(AC)
Cu (oh)2 Itu diakui secara instan karena menjadi endapan biru.
- Latihan 3
Garam apa yang akan terjadi dalam reaksi netralisasi berikutnya?
Al (oh)3(s) + 3hcl (ac) → ¿¿?
Aluminium hidroksida berperilaku sebagai basa bereaksi dengan asam klorida. Dalam reaksi netralisasi asam-basa (dari brnsted-lowry), air selalu terbentuk, sehingga produk lainnya harus aluminium klorida, ALCL3:
Al (oh)3(s) + 3hcl (ac) → alll3(AC) + 3H2SALAH SATU
Kali ini ALCL3 Itu tidak mengendap karena itu adalah garam (sampai batas tertentu) larut dalam air.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Ana Zita. (18 November 2019). Reaksi kimia. Dipulihkan dari: Todamatia.com
- Kashyap Vyas. (23 Januari 2018). 19 Reaksi Kimia Keren Yang Dipralunkan Ilmu Falcinating. Pulih dari: rekayasa menarik.com
- Chemistry yang cantik.net (s.F.). Reaksi. Dipulihkan dari: Beautifulchemistry.bersih
- Wikipedia. (2019). Reaksi kimia. Diperoleh dari: di.Wikipedia.org

