Pengurangan (Kimia)
- 2484
- 622
- Mr. Darrell Streich
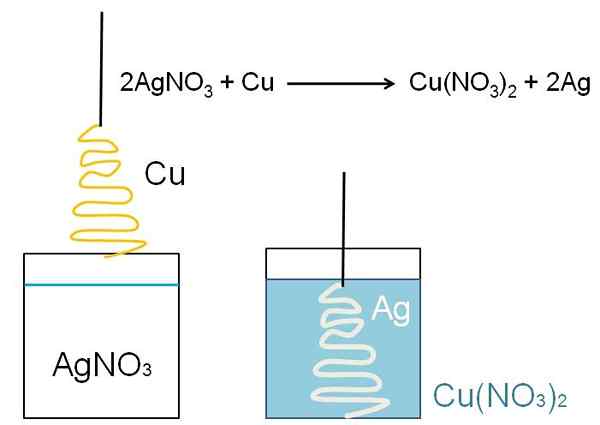
 Pengurangan Pohon Perak. Sumber: Gabriel Bolívar
Pengurangan Pohon Perak. Sumber: Gabriel Bolívar Apa pengurangannya?
Itu pengurangan Itu semua reaksi kimia di mana atom dari salah satu reagen akhirnya mendapatkan elektron, yang juga dapat dilihat dengan cara ini: lowongan atau "ketidaknyamanan" elektronik berkurang. Atom mendapatkan elektron ketika suatu spesies menyumbangkannya, yaitu ketika teroksidasi.
Jenis reaksi ini tidak dapat diberikan dengan sendirinya: jika suatu spesies menerima elektron, orang lain harus memberi mereka. Kalau tidak, materi akan dibuat dari ketiadaan, mengurangi atom setelah mendapatkan elektron kosong. Oleh karena itu, ini adalah semi -cahaya redoks (reduksi/oksidasi).
Contoh ilustratif dari reduksi yang dapat ditunjukkan di ruang kelas kelas adalah reaksi antara permukaan tembaga logam, dan larutan nitrat perak berair, AGNO3.
Dalam solusi, perak adalah kation ag+, dimuat secara positif. Ini, saat berinteraksi dengan permukaan tembaga, dalam bentuk pohon Natal, elektron diambil dari atom tembaga. Ketika ini terjadi, tembaga menggantikan perak dalam garam nitrat, dan sebagai hasilnya, tembaga nitrat terbentuk, tidak3)2.
Cu Cation2+ di sebelah no3- Mereka membilah solusinya, dan perak mewujudkan pohon Natal seolah menutupinya dengan salju.
Apa pengurangannya?
Dalam pengurangan telah dikatakan bahwa suatu spesies mendapatkan elektron. Bagaimana ini bisa diperiksa dalam persamaan kimia? Misalnya, dalam persamaan reaksi antara Cu dan Agno3, Bagaimana mengetahui kapan reduksi terjadi? Untuk memverifikasi itu, perlu menentukan angka atau status oksidasi.
Dapat melayani Anda: elektronegativitasUnsur -unsur, dalam keadaan alami mereka, memiliki definisi keadaan oksidasi sama dengan nol, karena diasumsikan bahwa mereka tidak kehilangan atau memenangkan elektron. Dengan demikian, logam padat memiliki keadaan oksidasi nol. Dengan demikian, perak melewati +1 (AG+) A 0 (Ag). Beban ion logam sama dengan keadaan oksidasi.
Di sisi lain, elektron berasal dari tembaga: bergerak dari 0 (cu) ke +2 (cu2+). Anion nitrat, tidak3- tetap tidak dapat diubah sementara kedua logam bertukar elektron. Oleh karena itu, persamaan dapat ditulis sebagai:
2ag+ + Cu => 2ag + cu2+
Perhatikan bahwa kedua beban dan atom seimbang.
Ini terdiri dari reduksi kimia: dalam gain elektron yang membuat keadaan oksidasi atom yang didapat elektron kurang positif.
Jumlah oksigen
Oksigen adalah atom yang sangat elektronegatif dan pengoksidasi, jadi ketika bentuk atom yang disusun dengan mereka (seperti oksida), mereka memiliki keadaan oksidasi positif. Semakin besar jumlah oksigen yang berinteraksi dengan atom, semakin positif oksidasinya. Atau apa yang sama, itu lebih teroksidasi.
Oleh karena itu, ketika suatu senyawa memiliki lebih sedikit atom oksigen, dikatakan bahwa itu kurang teroksidasi. Yaitu, atom kehilangan lebih sedikit elektron.
Contoh klasik dapat dilihat pada monoksida dan karbon dioksida. Untuk CO, karbon memiliki keadaan oksidasi +2, sedangkan untuk CO₂, status oksidasi adalah +4.
Jadi, jika dalam reaksi CO₂ diubah menjadi CO, dikatakan bahwa pengurangan sedang terjadi, karena karbon sekarang berinteraksi dengan oksigen dan bukan dua. Untuk reaksi yang berlawanan, co -transforming, ada pembicaraan tentang oksidasi karbon.
Dapat melayani Anda: ferrous chloride (fecl2): struktur, penggunaan, sifatIni berlaku untuk semua atom, terutama logam dalam oksida logamnya. Misalnya, CRO2 (Cr4+) dan cro3 (Cr6+).
Dalam persamaan kimia, di mana suatu spesies kehilangan oksigen sedangkan spesies lain mendapatkannya, dikatakan bahwa transfer oksigen terjadi.
Atom elektronegatif
Itu selalu dapat ditentukan jika ada pengurangan dengan mengubah status oksidasi menjadi nilai yang kurang positif. Seperti yang baru saja Anda jelaskan, cara cepat untuk menyadarinya tanpa membuat perhitungan mengamati apakah ada penurunan atom oksigen dalam suatu senyawa.
Hal yang sama dapat terjadi dengan atom lain yang lebih elektronegatif daripada atom yang menang atau kehilangan elektron.
Misalnya, jika CF4 bereaksi sedemikian rupa sehingga menjadi cho4, Dikatakan kemudian bahwa pengurangan terjadi, karena fluoride jauh lebih elektronegatif daripada atom hidrogen. Akibatnya, karbon kurang teroksidasi di CHO4 Itu di CF4, yang sama untuk mengatakan bahwa itu telah dikurangi.
Contoh
Pengurangan Kimia Organik
Contoh CF4 dan ch4 mencerminkan apa yang terjadi dalam reaksi organik, di mana pengurangan beban parsial atom dianggap sebagai gain elektronik. Ini sangat berlaku saat mempertimbangkan pengurangan kelompok fungsional teroksigenasi.
Misalnya, pertimbangkan kelompok ROH, RCHO dan COOH. Yang pertama sesuai dengan alkohol, di mana karbon terkait dengan oksigen (C-OH); Yang kedua adalah kelompok aldehida, di mana karbon membentuk ikatan rangkap dengan oksigen dan juga terkait dengan hidrogen (c = o-h), dan yang ketiga adalah gugus karboksil.
Dapat melayani Anda: beryl hydroxide (be (OH) 2)Dalam kelompok karboksil, karbon membentuk ikatan rangkap dengan O, dan tautan sederhana dengan O (HO-C = O) lainnya.
Oleh karena itu, reduksi terjadi jika asam karboksilat diubah menjadi alkohol:
Rcooh => roH
Ekstraksi logam
Pengurangan Kimia sangat penting dalam proses ekstraksi logam dari mineral mereka. Beberapa reaksi adalah:
HGS + O2 => Hg + jadi2
Merkuri sulfida direduksi menjadi merkuri logam.
Cu2S + o2 => 2cu + jadi2
Tembaga sulfida ke tembaga logam berkurang.
2Zns + 3o2 => 2zno + 2so2
Zno + C => Zn + Co (Perhatikan transfer O).
Seng sulfida pertama kali direduksi menjadi monoksida dan kemudian menjadi bentuk logamnya.
Keyakinan2SALAH SATU3 + 3co => 2fe + 3co2
Oksida besi dikurangi menjadi zat besi logam.
Wo3 + 3H2 => W + 3h2SALAH SATU
Dan tungsten trioksida dikurangi menjadi tungsten logam.
Sebagai latihan, jumlah oksidasi logam dapat ditentukan sebelum dikurangi.
Contoh lainnya
- Ion besi (III) dapat direduksi menjadi besi (II):
- Etino dapat direduksi menjadi Eteno:
- Etanal dapat direduksi menjadi etanol
Referensi
- Reaksi pengurangan oksidasi. Kimia pulih.Librettexts.org.
- Definisi Pengurangan Kimia. Pulih dari Thoughtco.com.




