Aturan wastafel atau multiplisitas maksimum

- 2719
- 353
- Irvin Reichel
Kami menjelaskan apa aturan atau prinsip multiplisitas maksimum, langkah -langkah untuk menerapkannya dan memberikan beberapa contoh
 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Apa aturan wastafel?
Itu Aturan wastafel, Juga disebut prinsip multiplisitas maksimum putaran, ini adalah aturan empiris yang digunakan untuk menulis konfigurasi elektronik absolut dari elemen kimia ketika mereka berada dalam keadaan mendasar mereka. Artinya, ini adalah aturan yang membantu memprediksi bagaimana elektron didistribusikan dalam orbital atom atom yang santai atau pada tingkat energi terendahnya.
Aturan wastafel mengatakan:
"... dalam atom yang dalam keadaan mendasar, elektron dari tingkat energi yang sama akan didistribusikan sedemikian rupa sehingga ada sebanyak mungkin duri paralel".
Aturan ini sesuai dengan salah satu prinsip dasar mekanika kuantum dan teori atom saat ini. Sangat berguna untuk memahami beberapa sifat dari elemen yang berbeda, terutama sifat magnetiknya. Ini karena atom tertarik atau ditolak oleh magnet karena mereka telah menghilang elektron dalam strukturnya.
Dari mana asal aturan wastafel atau multiplisitas maksimum?
Spektrum atom
Prinsip ini pertama kali mengucilkan fisikawan Jerman Friedrich Hund pada tahun 1927. Wastafel yang dipelajari spektrum serapan atom, yang memungkinkan pengukuran energi yang diserap secara eksperimental ketika terpapar radiasi elektromagnetik dari panjang gelombang yang memadai. Pengamatan eksperimental hanya dapat dijelaskan jika atom memiliki elektron sebanyak mungkin dengan putaran yang sama.
Elektron yang hilang
Selain spektrum atom, ada pengamatan eksperimental lain yang mengkonfirmasi konfigurasi elektronik yang diprediksi dengan menerapkan aturan HUND. Yang paling penting terdiri dari langkah -langkah eksperimental sifat magnetik atom yang memungkinkan untuk menentukan berapa banyak elektron yang hilang yang memiliki atom.
Itu bisa melayani Anda: elektrolisis airElektron yang hilang adalah yang sendirian dalam orbital, tanpa pasangan berputar yang berlawanan masing -masing.
Langkah -langkah untuk menerapkan aturan wastafel
Aturan wastafel berlaku saat kami menulis konfigurasi elektronik atom dalam keadaan mendasarnya. Ini berarti bahwa ini adalah aturan pelengkap dari aturan lain, seperti prinsip aufbau atau prinsip konstruksi (juga disebut aturan hujan) dan prinsip pengucilan pauli.
Hanya berlaku untuk kasus -kasus yang kami inginkan.
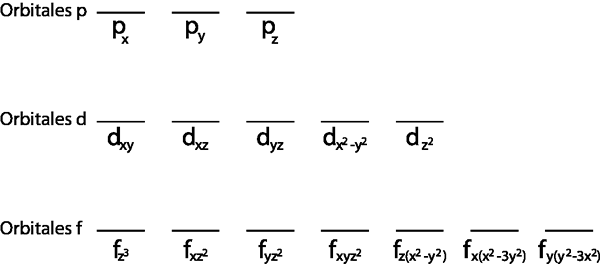
Selain itu, masuk akal untuk menerapkannya untuk lapisan Valencia, yaitu, tingkat energi yang tidak lengkap (tidak memiliki semua elektron yang pas di dalamnya). Kalau tidak, semua elektron akan dipasangkan untuk mematuhi prinsip pengecualian Pauli.
Penerapan aturan ini terdiri dari langkah -langkah berikut:
- Langkah 1: Gambar garis horizontal atau persegi panjang kecil untuk setiap orbital sub -level.
- Langkah 2: Tempatkan elektron pertama di orbital pertama dengan putaran Anda menunjuk ke atas.
- Langkah 3: Tempatkan elektron berikut di orbital berikutnya, juga menunjuk ke atas.
- Langkah 4: Lanjutkan seperti ini sampai elektron selesai atau tidak ada lagi orbital kosong.
- Langkah 5: Jika saat menempatkan elektron di setiap orbital masih ada elektron yang akan didistribusikan, ulangi langkah 2 hingga 4 tetapi menempatkan elektron dengan putarannya menunjuk ke bawah.
Untuk memahami bagaimana langkah -langkah ini berlaku, mari kita analisis beberapa contoh.
Contoh 1: Konfigurasi Elektronik Nitrogen
Nitrogen adalah elemen nomor 7, sehingga memiliki total 7 elektron yang berputar di sekitar nukleus. Elektron ini didistribusikan sebagai berikut, mengikuti aturan hujan:
Dapat melayani Anda: acetanylide (c8h9no)1s2 2s2 2 p3
Seperti yang bisa kita lihat, lapisan valensi nitrogen sesuai dengan level 2 energi (disebut lapisan L) di mana 8 elektron pas. Namun, nitrogen hanya memiliki 5 elektron valencia.
Di orbital S Hanya 2 elektron yang pas, jadi orbital 2S sepenuhnya penuh dan tidak masuk akal untuk menerapkan aturan wastafel untuk orbital ini.
Di sisi lain, sub -level 2p, yang berisi 3 orbital, tidak penuh. Tetapi bagaimana 3 elektron ini didistribusikan di ketiga orbital? Mereka didistribusikan mengikuti langkah -langkah aturan wastafel, yang disajikan di bawah ini:
Langkah 1: Gambar garis horizontal atau persegi panjang kecil untuk setiap orbital sub -level.
Karena sub -level 2p, ada tiga orbital yang merupakan 2pX, 2 pDan dan 2pz. Jadi, kita harus menggambar tiga garis horizontal atau tiga kotak atau persegi panjang:
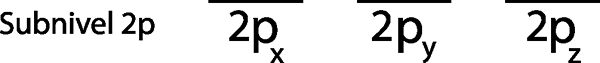
Masing -masing garis atau kotak ini mewakili orbital, seperti yang ditunjukkan oleh nama yang memiliki masing -masing.
Langkah 2: Tempatkan elektron pertama di orbital pertama dengan putaran Anda menunjuk ke atas.
Kami menempatkan elektron pertama di orbital 2pX Karena ini adalah orbital pertama dalam daftar.
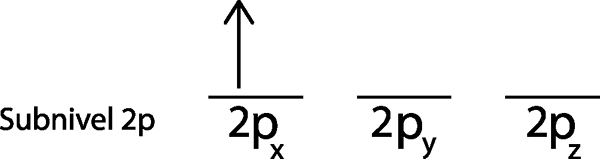
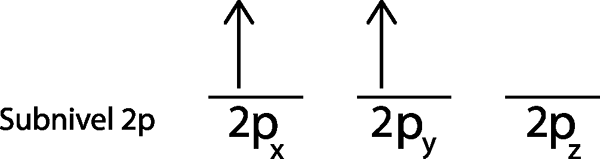
Langkah 3: Tempatkan elektron berikut di orbital berikutnya, juga menunjuk ke atas.
Elektron kedua terletak di orbital 2pDan
Langkah 4: Lanjutkan seperti ini sampai elektron selesai atau tidak ada lagi orbital kosong.
Dalam kasus kami, kami hanya perlu mendistribusikan 3 elektron, jadi kami hanya perlu menempatkan elektron terakhir di orbital terakhir dan voila:
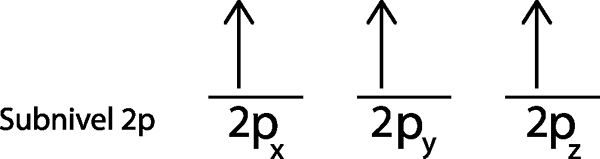
Seperti dapat dilihat, prinsip aturan multiplisitas atau wastafel maksimum memprediksi bahwa nitrogen atom harus memiliki 3 elektron yang hilang.
Dapat melayani Anda: nitrogen oksida (NOX)Dalam hal ini, tidak perlu menerapkan langkah 5, karena setelah langkah 4 kami dibiarkan tanpa elektron untuk didistribusikan.
Contoh 2: Konfigurasi Elektronik Besi
Besi adalah elemen 26 dan konfigurasi elektroniknya adalah:
1s2 2s2 2 p6 3S2 3p6 3d6 4s2
Dalam hal ini, kita dapat mencatat bahwa orbital dengan tingkat energi tertinggi adalah 4s, tetapi karena itu adalah logam transisi, zat besi memiliki orbital D sebagian penuh. Ini adalah orbital yang elektronnya akan kami distribusikan mengikuti aturan hund.
Langkah 1: Gambar garis horizontal atau persegi panjang kecil untuk setiap orbital sub -level.
Kami akan mengisi sub -tingkat 3D yang berisi 5 orbital:
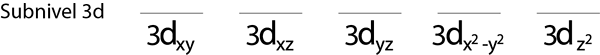
Langkah 2: Tempatkan elektron pertama di orbital pertama dengan putaran Anda menunjuk ke atas.
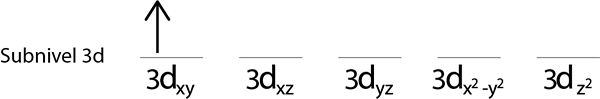
Langkah 3: Tempatkan elektron berikut dalam orbital berikut, juga menunjuk ke atas.
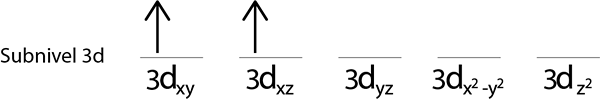
Langkah 4: Lanjutkan seperti ini sampai elektron selesai atau tidak ada lagi orbital kosong.
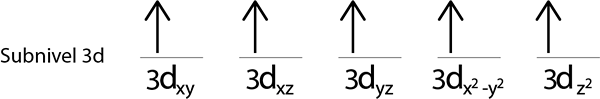
Langkah 5: Jika saat menempatkan elektron di setiap orbital masih ada elektron yang akan didistribusikan, ulangi langkah 2 hingga 4 tetapi menempatkan elektron dengan putarannya menunjuk ke bawah.
Karena kami masih memiliki elektron untuk didistribusikan setelah menempatkan elektron di setiap orbital 3D, yang terakhir dari 6 elektron ditempatkan dengan putaran yang berlawanan di orbital pertama.
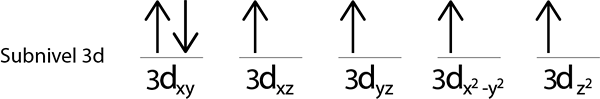
Ini adalah konfigurasi absolut dari atom besi dalam keadaan mendasarnya. Dalam hal yang sama, besi memiliki 4 elektron yang hilang dengan duri paralel.
Referensi
- Tanpa jawaban pertanyaan tentang multiplisitas maksimum atau aturan wastafel: apa yang harus dilakukan (2020). Diambil dari physis andquimica.com.
- Wastafel - Kimia (2021). Diambil dari costproject.org.
- Multiplisitas maksimum Sind (2020). Diambil dari prinsip.com.
- Aturan wastafel | Panduan Kimia (2012). Diambil dari chemistry.LAGUIA2000.com.

