Rubidio historia, properti, struktur, memperoleh, menggunakan

- 4915
- 212
- Tommie Smith
Dia Rubidium Ini adalah elemen logam yang dimiliki kelompok 1 dari tabel periodik: yaitu logam alkali, diwakili oleh simbol kimia RB. Namanya terdengar seperti Rubí, dan itu karena ketika spektrum emisinya ditemukan dia menunjukkan garis karakteristik merah yang intens.
Itu adalah salah satu logam paling reaktif yang ada. Ini adalah yang pertama dari logam alkali yang, meskipun sedikit padat, tenggelam ke dalam air. Ini juga bereaksi dengan dia lebih eksplosif dibandingkan dengan lithium, natrium dan kalium. Ada percobaan di mana ampul disimpan (gambar bawah) jatuh dan meledak di bak mandi.
 Ampul dengan gram rubidium yang disimpan di bawah atmosfer lembam. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]
Ampul dengan gram rubidium yang disimpan di bawah atmosfer lembam. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] Rubidio dibedakan dengan menjadi logam yang lebih mahal daripada emas yang sama; Tidak terlalu banyak karena kekurangannya, tetapi untuk distribusi mineralogi yang luas di kerak bumi dan kesulitan yang muncul saat mengisolasi kalium dan menghentikan senyawa.
Ini menunjukkan kecenderungan yang jelas untuk bergaul dengan kalium dalam mineral, menemukan pengotor. Tidak hanya dalam masalah geokimia membentuk duo dengan kalium, tetapi juga di bidang biokimia.
Organisme "membingungkan" ion k+ Bagi orang -orang RB+; Namun, Rubidio bukan elemen penting hingga saat ini, karena tidak diketahui peran apa yang ia mainkan dalam metabolisme. Meski begitu, suplemen rubidium telah digunakan untuk mengurangi kondisi medis tertentu seperti depresi dan epilepsi. Di sisi lain, kedua ion menembakkan nyala api ungu di panasnya.
Karena biayanya yang tinggi, aplikasinya tidak terlalu banyak didasarkan pada sintesis katalis atau bahan, tetapi sebagai komponen untuk berbagai perangkat dengan basis teoretis fisik. Salah satunya adalah jam atom, sel surya dan magnetometer. Itulah sebabnya kadang -kadang rubidium diambil sebagai logam yang diremehkan atau sedikit dipelajari.
[TOC]
Sejarah
Rubidio ditemukan pada tahun 1861 oleh ahli kimia Jerman Robert Bunsen dan Gustav Kirchhoff, menggunakan spektroskopi. Untuk melakukan ini, mereka menggunakan Bunsen Lighter dan Spectroscope, ditemukan dua tahun sebelumnya, selain teknik curah hujan analitik. Objek studinya adalah mineral lepidolit, yang menunjukkan koleksi Saxony, Jerman.
Mereka mulai dari 150 kg mineral lepidolit, yang mereka perlakukan dengan asam kloroplatinat, h2Ptcl6, Untuk mengendapkan kalium heksakloroplatinat, k2Ptcl6. Namun, ketika mereka mempelajari spektrum mereka dengan membakarnya di Bunsen yang lebih ringan, mereka menyadari bahwa mereka memamerkan garis emisi yang tidak bertepatan saat itu dengan elemen lain.
Spektrum emisi elemen baru ini ditandai dengan memiliki dua garis yang ditentukan dengan baik di wilayah merah. Itulah sebabnya dia dibaptis dengan nama 'rubidus' yang berarti 'merah gelap'. Kemudian, Bunsen dan Kirchhoff berhasil memisahkan RB2Ptcl6 dari k2Ptcl6 dengan kristalisasi yang difraksinasi; Untuk akhirnya menguranginya ke garam klorida Anda menggunakan hidrogen.
Mengidentifikasi dan mengisolasi garam dari elemen rubidio baru, ahli kimia Jerman hanya perlu menguranginya ke keadaan logam mereka. Untuk mencapai hal ini, mereka mencoba dengan dua cara: Oleskan elektrolisis ke rubidium klorida, atau panaskan garam yang mudah untuk dikurangi, seperti Tartrato. Dengan demikian, rubidio logam lahir.
Sifat fisik dan kimia
Penampilan
Logam abu -abu perak. Sangat lembut sehingga terlihat seperti mentega. Biasanya dikemas di dalam ampul kaca, di mana atmosfer inert mendominasi yang melindunginya dari bereaksi dengan udara.
Nomor Atom (Z)
37
Masa molar
85.4678 g/mol
Titik lebur
39 ºC
Titik didih
688 ºC
Kepadatan
Pada suhu kamar: 1.532 g/cm3
Pada titik leleh: 1,46 g/cm3
Kepadatan rubidium lebih unggul daripada air, jadi akan tenggelam sambil bereaksi dengan keras dengan itu.
Panas fusi
2.19 kJ/mol
Panas penguapan
69 kJ/mol
Elektronegativitas
0,82 pada skala Pauling
Afinitas elektronik
46,9 kJ/mol
Energi ionisasi
-Pertama: 403 kJ/mol (RB+ gas)
-Kedua: 2632.1 kJ/mol (RB2+ gas)
-Ketiga: 3859.4 kJ/mol (RB3+ gas)
Radio atom
248 pm (empiris)
Konduktivitas termal
58.2 w/(m · k)
Resistivitas listrik
128 NΩ · m pada 20 ° C
Kekerasan Mohs
0.3. Oleh karena itu, bahkan bedak lebih sulit dari rubidium logam.
Reaktivitas
 Latihan api untuk Rubidium. Ketika dia bereaksi, dia mengucapkan selamat tinggal pada nyala api ungu. Sumber: Didaktische.Medien [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Latihan api untuk Rubidium. Ketika dia bereaksi, dia mengucapkan selamat tinggal pada nyala api ungu. Sumber: Didaktische.Medien [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Rubidio adalah salah satu logam alkali yang paling reaktif, setelah Cesio dan Francio. Dia nyaris tidak terpapar ke udara mulai terbakar, dan jika dia hancur, dia menembak percikan bercahaya. Jika dia dipanaskan, dia juga memancarkan api ungu (gambar superior), yang merupakan tes positif untuk ion RB+.
Dapat melayani Anda: ididio 192Bereaksi dengan oksigen untuk membentuk campuran peroksida (RB2SALAH SATU2) dan superoksida (RBO2). Meskipun tidak bereaksi dengan asam dan basa, ia melanggarnya dengan air, menghasilkan rubidium dan hidroksida gas hidrogen:
RB + H2Atau (l) => rboh (ac) + h2(G)
Bereaksi dengan hidrogen untuk membentuk hidrida yang sesuai:
RB + H2(g) => 2rbh (s)
Dan juga dengan halogen dan belerang secara eksplosif:
2RB (S) + CL2(g) => rbcl (s)
2RB (S) + S (L) => RB2H.H)
Meskipun rubidium tidak dianggap sebagai unsur beracun, itu berpotensi berbahaya dan mewakili risiko api ketika bersentuhan dengan air dan oksigen.
Struktur dan konfigurasi elektronik
Atom rubidio diatur sedemikian rupa sehingga mereka membangun kristal struktur kubik yang berpusat di tubuh (BCC). Struktur ini adalah karakteristik untuk logam alkali, yang ringan dan cenderung mengapung di atas air; Kecuali Rubidium Down (Cesio dan Francio).
Dalam kristal Rubidio BCC, atom RB mereka berinteraksi satu sama lain berkat tautan logam. Ini diatur oleh "lautan elektron" dari lapisan valensi, dari orbital 5S sesuai dengan konfigurasi elektroniknya:
[Kr] 5s1
Semua orbital 5s dengan satu -satunya elektronnya tumpang tindih di semua dimensi kristal logam rubidio. Namun, interaksi ini lemah, karena karena kelompok logam alkali diturunkan, orbital menjadi lebih difus dan, oleh karena itu, tautan logam melemah.
Itulah sebabnya titik leleh rubidium adalah 39 ºC. Juga, ikatan logamnya yang lemah menjelaskan kelembutan padatannya; sangat lembut sehingga tampaknya menjadi mentega perak.
Tidak ada cukup informasi bibliografi mengenai perilaku kristal mereka di bawah tekanan tinggi; Jika ada fase terpadat dengan sifat unik seperti dengan natrium.
Angka oksidasi
Konfigurasi elektroniknya pernah menunjukkan bahwa rubidium sangat cenderung kehilangan satu -satunya elektronnya menjadi isolektronik ke gas kripton gas mulia. Ketika itu terjadi, kation monovalen dibentuk RB+. Dikatakan bahwa dalam senyawanya memiliki nomor oksidasi +1 ketika keberadaan kation ini diasumsikan.
Karena tren rubidium untuk teroksidasi, asumsi bahwa ada ion RB+ Dalam senyawanya berhasil, yang pada gilirannya menunjukkan karakter ionik dari senyawa ini.
Di hampir semua senyawa rubidium ini menunjukkan jumlah oksidasi +1. Contohnya adalah sebagai berikut:
-Rubid Chloride, RBCL (RB+Cl-)
-Rubidio Hydroxide, RBoh (RB+ Oh-)
-Rubidio Carbonate, RB2BERSAMA3 (RB2+BERSAMA32-)
-Rubidio monoxide, RB2Atau (rb2+SALAH SATU2-)
-Rubidium superoksida, rbo2 (RB+SALAH SATU2-)
Bahkan jika sangat jarang, rubidium juga bisa memiliki angka oksidasi negatif: -1 (RB-). Dalam hal ini, kita akan berbicara tentang "rubidiuro" jika dia membentuk senyawa dengan elemen yang kurang elektronegatif darinya, atau jika dia menyerahkan dalam kondisi khusus dan ketat.
Cluster
Ada senyawa di mana setiap atom RB memiliki angka oksidasi dengan nilai fraksional. Misalnya, di RB6Atau (rb62+SALAH SATU2-) dan RB9SALAH SATU2 (RB94+SALAH SATU22-) Beban positif didistribusikan di antara satu set atom RB (kelompok). Jadi, di RB6Atau bilangan oksidasi secara teori adalah +1/3; saat berada di RB9SALAH SATU2, + 0.444 (4/9).
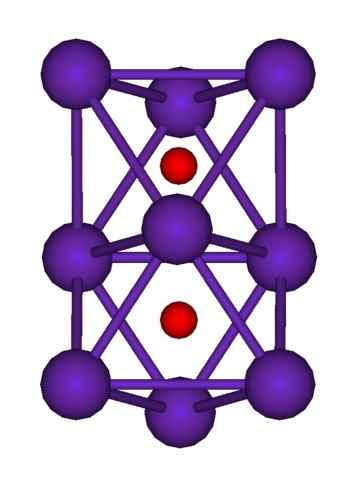 Struktur Cluster RB9O2. Sumber: Axiosaurus [domain publik]
Struktur Cluster RB9O2. Sumber: Axiosaurus [domain publik] Struktur cluster RB ditunjukkan di atas9SALAH SATU2 diwakili oleh model bola dan batang. Perhatikan bagaimana sembilan atom RB "melampirkan" anion atau2-.
Dengan cara penjelasan, seolah -olah bagian dari kristal logam asli rubidium tetap tidak berubah saat memisahkan dari kristal ibu. Mereka kehilangan elektron dalam prosesnya; mereka yang diperlukan untuk menarik atau2-, dan muatan positif yang dihasilkan didistribusikan di antara semua atom dari cluster tersebut (set atau agregat atom RB).
Dengan demikian, dalam kelompok rubidium ini, keberadaan RB tidak dapat diasumsikan secara formal+. RB6Atau dan RB9SALAH SATU2 Mereka mengklasifikasikan sebagai rubidium suboksida, di mana anomali yang jelas ini dipenuhi untuk memiliki kelebihan atom logam dalam kaitannya dengan anion oksida.
Dimana itu dan dapatkan
kerak bumi
 Sampel mineral lepidolit. Sumber: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Sampel mineral lepidolit. Sumber: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Rubidio adalah elemen paling berlimpah dari kerak bumi, dengan kelimpahan yang sebanding dengan seng, timbal, cesium dan logam tembaga. Detailnya adalah bahwa ion mereka disebarluaskan secara luas, sehingga tidak mendominasi dalam mineral apa pun sebagai unsur logam utama, dan bijihnya juga langka.
Dapat melayani Anda: reagen grignard: persiapan, aplikasi, contohKarena alasan inilah Rubidio adalah logam yang sangat mahal, bahkan lebih dari emas yang sama, karena proses memperoleh dari MENAS -nya kompleks karena kesulitan eksploitasi -nya.
Di alam, mengingat reaktivitasnya, rubidium tidak dalam keadaan asli, tetapi sebagai oksida (RB2O), klorida (rbcl) atau disertai dengan anion lain. Ion RB "gratis" itu+ Mereka berada di laut dengan konsentrasi 125 μg/L, serta di mata air panas dan sungai.
Di antara mineral kerak bumi yang mengandungnya dalam konsentrasi kurang dari 1% yang kita miliki:
-Leucita, k [alsi2SALAH SATU6]
-Polucita, CS (ya2Halo6· NH2SALAH SATU
-Carnalita, kmgcl3· 6h2SALAH SATU
-Zinnwaldita, Klifeal (ALSI3)SALAH SATU10(Oh, f)2
-Amazonita, PB, Kalsi3SALAH SATU8
-Petalita, Lialsi4SALAH SATU10
-Biotita, K (mg, iman)3Alsi3SALAH SATU10(Oh, f)2
-Rubiclina, (RB, K) ALSI3SALAH SATU8
-Lepidolita, K (Li, AL)3(Ya, AL)4SALAH SATU10(F, oh)2
Asosiasi Geokimia
Semua mineral ini berbagi satu atau dua kesamaan: mereka adalah kalium, cesium atau lithium silikat, atau garam mineral dari logam ini.
Ini berarti bahwa Rubidio memiliki kecenderungan kuat untuk bergaul dengan kalium dan cesio; Bahkan dapat menggantikan kalium selama kristalisasi mineral atau batu, seperti yang terjadi di ladang pegmatitas ketika magma mengkristal. Dengan demikian, Rubidio adalah produk sampingan dari eksploitasi dan pemurnian batu -batu ini dan mineral mereka.
Rubidio juga bisa berada di batuan umum seperti granit, lempung dan basal, dan bahkan endapan karbon. Dari semua sumber alami, lepidolit mewakili bijih utamanya dan dari mana ia dieksploitasi secara komersial.
Di karnalit, di sisi lain, rubidio dapat ditemukan sebagai pengotor RBCL dengan kandungan 0,035%. Dan dalam konsentrasi yang lebih besar ada endapan polucitas dan rubiclina, yang dapat memiliki hingga 17% dari rubidium.
Hubungan geokimia dengan kalium disebabkan oleh kesamaan radio ioniknya; RB+ lebih besar dari k+, Tetapi perbedaan dalam ukuran bukanlah halangan bagi yang pertama untuk menggantikan yang kedua dalam kristal mineralnya.
Kristalisasi fraksional
Apakah itu didasarkan pada lepidolit atau polucita, atau salah satu mineral yang disebutkan di atas, tantangannya tetap sama dengan tingkat yang lebih besar atau lebih kecil: memisahkan rubidium dari kalium dan ksium; yaitu, oleskan teknik pemisahan campuran yang memungkinkan senyawa atau garam rubidium di satu sisi, dan kalium dan cesium, di sisi lain.
Ini sulit karena ion -ion ini (k+, RB+ dan cs+) berbagi kesamaan kimia yang hebat; Mereka bereaksi dengan cara yang sama untuk membentuk garam yang sama, yang nyaris tidak berbeda satu sama lain berkat kepadatan dan kelarutan mereka. Itulah sebabnya kristalisasi fraksinasi digunakan, sehingga mereka dapat secara perlahan dan dikendalikan.
Misalnya, teknik ini digunakan untuk memisahkan campuran karbonat dan tawas dari logam ini. Proses rekristalisasi harus diulang beberapa kali untuk menjamin kristal ion utuh dan gratis; Garam rubidium yang mengkristal dengan ion k+ atau CS+ di permukaan atau di dalamnya.
Teknik yang lebih modern, seperti penggunaan resin pertukaran ion, atau mahkota sebagai agen yang kompleks, juga memungkinkan ion RB+.
Elektrolisis atau pengurangan
Setelah dimungkinkan untuk memisahkan dan memurnikan garam rubid, langkah berikutnya dan terakhir adalah mengurangi kation RB+ ke logam padat. Untuk melakukan ini, garam meleleh dan mengalami elektrolisis untuk mengendapkan rubidium dalam katoda; atau zat pereduksi yang kuat, seperti kalsium dan natrium, digunakan, mampu kehilangan elektron dengan cepat dan dengan demikian mengurangi rubidium.
Isotop
Rubidio ditemukan di bumi sebagai dua isotop alami: 85RB dan 87RB. Yang pertama memiliki kelimpahan 72,17%, sedangkan yang kedua dari 27,83%.
Dia 87RB bertanggung jawab atas logam ini menjadi radioaktif; Namun, radiasinya tidak berbahaya dan bahkan bermanfaat untuk analisis kencan. Setengah -Life Anda (T1/2) adalah 4.9 · 1010 bertahun -tahun, yang periode waktunya melebihi usia alam semesta. Saat meluruh, itu menjadi isotop stabil 87Tn.
Berkat ini, isotop ini telah digunakan untuk menentukan usia mineral dan batuan darat yang ada sejak awal bumi.
Selain isotop 85RB dan 87RB, ada sintetis lain dan radioaktif dengan variabel dan waktu hidup yang jauh lebih pendek; Misalnya, dia 82RB (T1/2= 76 detik), 83RB (T1/2= 86.2 hari), 84RB (T1/2= 32.9 hari) dan 86RB (T1/2= 18.7 hari). Dari mereka semua, 82RB adalah yang paling banyak digunakan dalam studi medis.
Risiko
Logam
Rubidio adalah logam yang sangat reaktif sehingga harus disimpan dalam ampul kaca di bawah atmosfer lembam sehingga tidak bereaksi dengan oksigen udara. Jika kejadian ampul, logam dapat ditempatkan dalam minyak tanah atau mineral untuk melindunginya; Namun, itu akan berakhir mengoksidasi oksigen terlarut di dalamnya, menimbulkan rubidium peroksida.
Itu dapat melayani Anda: natrium sianida (NACN): struktur, sifat, risiko, penggunaanJika sebaliknya diputuskan untuk meletakkannya di atas kayu, misalnya, itu akan berakhir terbakar dengan nyala api ungu. Jika ada banyak kelembaban, itu akan terbakar hanya dengan fakta terkena udara. Ketika sepotong besar rubidium dihindari pada volume air, ia mengeksploitasi dengan kuat, mencapai gas yang diproduksi hidrogen yang terbakar.
Oleh karena itu, rubidium adalah logam yang harus dimanipulasi, karena semua reaksinya praktis eksplosif.
Ion
Tidak seperti rubidium logam, ion RB -nya+ Mereka tidak mewakili risiko yang jelas untuk makhluk hidup. Ini larut dalam air berinteraksi dengan sel -sel dengan cara yang sama seperti ion k+.
Oleh karena itu, rubidium dan kalium memiliki perilaku biokimia yang serupa; Namun, rubidium bukan elemen penting, sedangkan kalium ya. Dengan cara ini, sejumlah besar RB+ Mereka dapat menumpuk di interior sel, sel darah merah dan visera tanpa berdampak negatif pada tubuh hewan apa pun.
Bahkan, telah diperkirakan bahwa seorang pria dewasa dengan massa 80 kg mengandung sekitar 37 mg rubidio; Dan bahwa di samping itu, peningkatan konsentrasi ini dalam urutan 50 hingga 100 kali tidak menyebabkan gejala yang tidak diinginkan.
Namun, ion RB berlebih+ bisa berakhir pindah ke ion k+; Dan akibatnya, individu akan menderita kejang otot yang sangat kuat sampai mati.
Secara logis, garam atau senyawa rubidium dapat segera memicu ini, jadi tidak ada yang harus dicerna. Selain itu, dapat menyebabkan luka bakar kontak sederhana, dan di antara fluoride paling beracun (RBF), hidroksida (RBOH) dan sianida (RBCN) dari rubidium.
Aplikasi
Pengumpul gas
Rubidio telah digunakan untuk menangkap atau menghilangkan jejak gas yang mungkin ada di tabung yang disegel vakum. Justru karena kecenderungan tinggi mereka untuk menangkap oksigen dan kelembaban di dalamnya, mereka menghilangkannya di permukaannya sebagai peroksida.
Piroteknik
Saat garam rubidio membakar api ungu-merah yang khas. Beberapa kembang api memiliki garam ini dalam komposisi mereka sehingga mereka meledak dengan warna -warna ini.
Suplemen
Rubidio Chloride telah diresepkan untuk memerangi depresi, karena penelitian menentukan defisit elemen ini pada individu yang menderita kondisi medis ini. Itu juga telah digunakan sebagai obat penenang dan untuk mengobati epilepsi.
Kondensat Bose-Einstein
Atom isotop 87RB digunakan untuk membuat kondensat Bose-Einstein pertama. Keadaan materi ini adalah bahwa atom pada suhu yang cukup dekat dengan nol absolut (0 k), dikelompokkan atau "condensan", berperilaku seolah -olah mereka adalah satu.
Dengan demikian, Rubidio adalah protagonis dari kemenangan ini di bidang fisika, dan Eric Cornell, Carl Wieman dan Wolfgang Ketterle yang menerima Hadiah Nobel pada tahun 2001 berkat pekerjaan ini untuk pekerjaan ini.
Diagnosis tumor
Radioisotop sintetis 82Peluruhan RB dengan memancarkan positrones, yang digunakan untuk menumpuk dalam tissue yang kaya kalium; Seperti yang terletak di otak atau hati. Oleh karena itu digunakan untuk menganalisis fungsi jantung dan adanya tumor yang mungkin di otak melalui tomografi emisi positron.
Komponen
Ion rubidio telah menemukan ruang dalam berbagai jenis bahan atau campuran. Misalnya, paduan mereka dengan emas, cesium, merkuri, natrium dan kalium telah dibuat. Telah ditambahkan ke kaca dan keramik mungkin untuk meningkatkan titik leleh mereka.
Dalam sel surya perovskitas mereka telah ditambahkan sebagai komponen penting. Demikian juga, kemungkinan penggunaannya telah dipelajari sebagai generator termoelektrik, bahan transmisi panas di ruang angkasa, bahan bakar dalam motor propulsi ionik, media elektrolitik untuk baterai alkaline dan magnetometer atom.
Jam tangan atom
Dengan Rubidium dan berhenti, jam tangan atom yang terkenal telah diproduksi, sangat tepat, digunakan misalnya dalam satelit GPS yang dengannya pemilik smartphone mereka dapat mengetahui lokasi mereka saat bergerak di jalan.
Referensi
- Bond Tom. (29 Oktober 2008). Rubidium. Dipulihkan dari: ChemistryWorld.com
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Rubidium. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2019). Rubidium. Database pubchem. CID = 5357696. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Chellan, hlm., & Sadler, P. J. (2015). Elemen Kehidupan dan Obat -obatan. Transaksi filosofis. Seri A, Ilmu Matematika, Fisik, dan Teknik, 373 (2037), 20140182. Doi: 10.1098/RSTA.2014.0182
- May Foundation for Medical Education and Research. (2019). Rubidium RB 82 (rute intravena). Pulih dari: mayoclinic.org
- Marques Miguel. (S.F.). Rubidium. Pulih dari: nautilus.Fis.UC.Pt
- James L. Pewarna. (12 April 2019). Rubidium. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Kata. Doug Stewart. (2019). Fakta Elemen Rubidium. Chemicool. Pulih dari: chemicool.com
- Michael Pilgaard. (10 Mei 2017). Reaksi kimia rubidium. Pulih dari: pilgaardelegs.com

