Garam Diazonium

- 2287
- 573
- Dewey Runolfsdottir
Kami menjelaskan apa garam diazonium, bagaimana sifat dan aplikasinya terbentuk
Apa garam diazonium?
Itu Garam Diazonium Mereka adalah senyawa organik di mana ada interaksi ionik antara kelompok azo (-n2+) Dan anion x- (Cl-, F-, Ch3Mendekut-, dll.). Formula kimianya yang umum adalah RN2+X-, dan dalam hal ini rantai samping R mungkin merupakan kelompok alifatik atau gugus aril; yaitu cincin aromatik.
Pada gambar yang lebih rendah, struktur ion arenodiazonium diwakili. Bola biru sesuai dengan kelompok azo, sementara hitam dan putih membentuk cincin aromatik dari gugus fenil. AZ+≡N).

Namun, ada struktur resonansi yang mendelokalisasi beban positif ini, misalnya, dalam atom nitrogen tetangga: -n = n+. Ini berasal ketika beberapa elektron membentuk tautan diarahkan ke atom nitrogen di sebelah kiri.
Demikian juga, beban positif ini mampu mendemeksiasi melalui sistem PI dari cincin aromatik. Sebagai akibatnya, garam diazonium aromatik lebih stabil daripada alifatik, karena beban positif tidak dapat demokasi sepanjang rantai karbon (CH3, Ch2Ch3, dll.).
Pelatihan
Garam ini berasal dari reaksi amina primer dengan campuran asam nitrium nitrit (nano2).
Amina sekunder (r2Nh) dan tersier (r3N) Produk nitrogen lainnya seperti n-nitrosoamine (yang merupakan minyak kekuningan), garam amina (r3Hn+X-) dan senyawa n-nitrosonium.
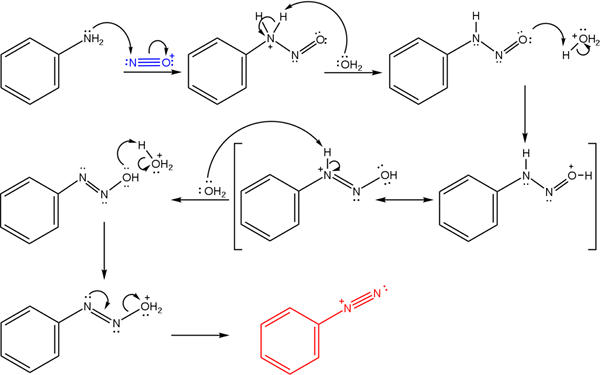
Gambar superior menggambarkan mekanisme dimana pembentukan garam diazonium, atau juga dikenal sebagai reaksi diazotisasi diatur.
Dapat melayani Anda: Chrome (CR)Reaksi dimulai dari fenilamin (ar-nh2), yang melakukan serangan nukleofilik pada atom kation nitrosonium (tidak+). Kation ini diproduksi oleh campuran nano2/Hx, di mana x biasanya cl; Artinya, HCl.
Pembentukan kation nitrosonium melepaskan air di tengah, yang merebut proton nitrogen yang dimuat secara positif.
Kemudian, molekul air yang sama ini (atau spesies asam lain berbeda dari H3SALAH SATU+) menghasilkan proton ke oksigen, mendemokrasi beban positif dalam atom nitrogen yang kurang elektronegatif).
Sekarang, air lagi tidak terlindungi ke nitrogen, kemudian menghasilkan molekul diazohidroksida (antepenultimate dari urutan).
Karena mediumnya bersifat asam, diazohidroksida menderita dehidrasi kelompok OH; Untuk menangkal lowongan elektronik, torsi gratis dari triple link dari grup Azo.
Dengan cara ini, di akhir mekanisme bencenodiazonium klorida tetap dalam larutan (c6H5N2+Cl-).
Properti
Secara umum, garam diazonium tidak berwarna dan kristal, larut dan stabil pada suhu rendah (kurang dari 5 ° C).
Beberapa garam ini sangat sensitif terhadap dampak mekanis, sehingga manipulasi fisik dapat meledakkannya. Akhirnya, mereka bereaksi dengan air untuk membentuk fenol.
Reaksi perpindahan
Garam Diazonium adalah nitrogen molekul potensial, yang pembentukannya merupakan penyebut umum dari reaksi perpindahan. Dalam hal ini, suatu spesies x menggantikan kelompok azo yang tidak stabil, melarikan diri sebagai n2(G).
Reaksi Sandmeyer
RNA2+ + Cucl => arcl + n2 + Cu+
RNA2+ + Cucn => arcn + n2 + Cu+
Reaksi Gatterman
RNA2+ + Cux => arx + n2 + Cu+
Tidak seperti reaksi Sandmeyer, reaksi Gatterman memiliki tembaga logam, bukan halida; Artinya, Cux dihasilkan In situ.
Reaksi Schiemann
[RNA2+] BF4- => Arf + bf3 + N2
Dapat melayani Anda: keton: jenis, properti, nomenklatur, penggunaan, contohReaksi Schiemann ditandai dengan dekomposisi termal benzezonium fluoroborate.
Reaksi Gomberg Bachmann
[RNA2+] Cl- + C6H6 => Ar - c6H5 + N2 + Hcl
Perpindahan lainnya
RNA2+ + Ki => ari + k+ + N2
[RNA2+] Cl- + H3PO2 + H2O => C6H6 + N2 + H3PO3 + Hcl
RNA2+ + H2O => aroh + n2 + H+
RNA2+ + Stempel2 => Arno2 + N2 + Cu+
Reaksi redoks
Garam Diazonium dapat direduksi menjadi arilhidrazin, menggunakan campuran CNCl2/Hcl:
RNA2+ => Arnhnh2
Mereka juga dapat direduksi menjadi arilamin dalam pengurangan yang lebih kuat dengan Zn/HCl:
RNA2+ => Rnah2 + NH4Cl
Dekomposisi fotokimia
[RNA2+] X- => Arx + n2
Garam diazonium sensitif terhadap terurai dengan kejadian radiasi ultraviolet, atau pada panjang gelombang yang sangat dekat.
Reaksi kopling azo
RNA2+ + Ar'h → RNA2Ar ' + h+
Reaksi ini mungkin yang paling berguna dan serbaguna dari garam diazonium. Garam ini adalah elektrofil yang lemah (cincin memindahkan beban positif dari kelompok azo). Untuk bereaksi dengan senyawa aromatik, mereka harus diisi secara negatif, sehingga menyebabkan senyawa azos.
Reaksi berlalu dengan kinerja yang efisien antara pH 5 dan 7. Dalam pH asam kopling lebih rendah karena proton kelompok azo, membuat serangan cincin negatif tidak mungkin.
Juga, dalam pH dasar (lebih besar dari 10) garam diazonium bereaksi dengan OH- Untuk menghasilkan diazohydroxide, yang relatif lembam.
Struktur jenis senyawa organik ini memiliki sistem PI terkonjugasi yang sangat stabil, yang elektronnya menyerap dan memancarkan radiasi dalam spektrum yang terlihat.
Akibatnya, senyawa azo ditandai dengan berwarna -warni. Karena properti ini mereka juga disebut warna azoik.
Dapat melayani Anda: molaritas: konsentrasi, unit, perhitungan, latihan
Gambar superior menggambarkan konsep penggabungan dengan oranye metil sebagai contoh. Di tengah strukturnya, kelompok azo dapat diamati melayani sebagai konektor dari dua cincin aromatik.
Manakah dari dua cincin yang merupakan elektrofi di awal kopling? Yang ada di sebelah kanan, karena kelompok sulfonat (-so3) Lepaskan kepadatan cincin elektronik, membuatnya lebih elektrofil.
Aplikasi

Salah satu aplikasi yang paling komersial adalah produksi pewarna dan pigmen, juga mencakup industri tekstil di tapak kain. Senyawa azoik ini berlabuh ke situs molekul spesifik polimer, sekarat warna.
Karena dekomposisi fotolitiknya, itu (kurang dari sebelumnya) digunakan dalam reproduksi dokumen. Sebagai? Area kertas yang ditutupi oleh plastik khusus dilepas dan kemudian larutan fenol dasar diterapkan, mewarnai huruf atau desain biru.
Dalam sintesis organik mereka digunakan sebagai titik awal untuk banyak turunan aromatik.
Akhirnya, mereka memiliki aplikasi di bidang bahan pintar. Dalam hal ini, permukaan (emas, misalnya) terkait, memungkinkannya untuk memberikan respons kimia terhadap rangsangan fisik eksternal.

