Solusi penyerap goncangan

- 4529
- 1078
- Miss Wm Hudson
Kami menjelaskan apa solusi redaman, sifat, komponen, jenis, dan memberikan beberapa contoh
 Solusi penyerap guncangan mengatur pH di sekitar nilai tertentu
Solusi penyerap guncangan mengatur pH di sekitar nilai tertentu Apa itu solusi redaman?
Itu Solusi penyerap goncangan, Juga disebut buffer, pH atau regulator buffer, adalah larutan air yang dibentuk oleh asam lemah dan basa konjugatnya atau basa lemah dan asam terkonjugasi.
Mereka disebut solusi peredam kejut, karena mereka memiliki kemampuan untuk menghilangkan perubahan pH setelah penambahan asam atau basa dalam jumlah kecil, bahkan jika itu adalah asam atau basa yang kuat.
Solusi penyerap goncangan sangat berguna, karena memungkinkan pH konstan. Ada banyak reaksi kimia yang membutuhkan pH spesifik dan konstan untuk berfungsi dengan baik.
Sifat solusi morpainary
Mereka adalah solusi berair
Baik konsep pH dan skala pH hanya masuk akal dalam larutan berair, sehingga semua buffer atau solusi redaman disiapkan dalam air.
Operasinya didasarkan pada keseimbangan asam-basa dan prinsip-prinsip Le Chatlier
Buffer didasarkan pada reaksi disosiasi asam/basa reversibel yang berada dalam kesetimbangan. Dengan menambahkan asam atau basa yang kuat ke lingkungan, keseimbangan ini terganggu, sehingga sistem bereaksi untuk menangkal gangguan, mengikuti prinsip -prinsip le catelier. Beginilah Buffer Mengelola Bantalan Perubahan Hebat dalam PH.
PH Anda mudah dihitung dengan persamaan Henderson-Haselbalch
Terlepas dari jenis larutan penyerap goncangan apa, pH baiknya sebelum dan sesudah menambahkan sejumlah kecil asam atau basa kuat, ia dapat dihitung dengan menggunakan persamaan Henderson-Hohaselbalch:
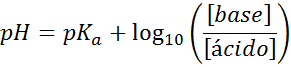
Di mana [basa] mengacu pada konsentrasi molar basa (atau garam basa konjugat) dan [asam] mengacu pada konsentrasi molar asam (atau garam asam terkonjugasi).
Dapat melayani Anda: bahan elastisMereka mampu menetralkan sebagian asam dan basa
Larutan redaman terdiri dari zat basa dan zat asam, yang masing -masing dapat menetralkan basa dan asam. Untuk alasan ini, mereka dapat menghilangkan pH setelah penambahan asam kuat dan basa kuat.
Operasinya tergantung pada suhu
PH larutan buffer tergantung pada keasaman atau konstanta dasar asam atau basa lemah yang mengandungnya. Konstanta ini tergantung pada suhu, sehingga pengoperasian solusi ini juga tergantung pada suhu.
Semakin terkonsentrasi, semakin besar kemampuannya untuk bantalan atau mengatur pH
Kapasitas redaman tergantung pada konsentrasi total larutan lebih besar dari konsentrasi akhir asam atau basa kuat yang ditambahkan. Untuk alasan ini, semakin besar konsentrasi total larutan buffer, semakin besar kemampuannya untuk bantalan asam atau basa yang kuat.
Komponen solusi redaman atau buffer
Secara kimia, solusi redaman dibentuk hanya oleh dua komponen. Komponen -komponen ini dapat berupa asam lemah yang dicampur dengan garam dari basa konjugatnya atau basa lemah yang dicampur dengan garam asam terkonjugasi.
Ada dua cara berbeda untuk mendapatkan komponen -komponen ini dalam solusi yang sama, seperti yang akan kita lihat di bawah:
1. Persiapan Buffer Pencampuran Solusi dari Komponennya
Ini adalah cara paling langsung untuk menyiapkan solusi buffer. Untuk melakukan ini, terpisah larutan asam lemah (misalnya, asam asetat) dan garam basa konjugat (misalnya, natrium asetat) disiapkan larutan terpisah). Maka kedua solusi secara bertahap bercampur sampai pH yang diinginkan.
Itu dapat melayani Anda: ion amonium (NH4+): Formula, Properti dan Penggunaan
- Solusi dicampur sedikit demi sedikit sampai pH yang diinginkan
2. Persiapan buffer dengan netralisasi parsial larutan asam lemah
Dalam hal ini, larutan asam lemah dibuat dengan konsentrasi total yang diinginkan, dan kemudian natrium atau kalium hidroksida ditambahkan sedikit demi sedikit sampai mencapai pH yang diinginkan.
Jenis Solusi Buffer
Solusi penyerap kejut dapat diklasifikasikan sesuai dengan jenis komponen yang mereka miliki atau sesuai dengan pH akhir mereka.
Menurut jenis komponen:
- Buffer dasar yang lemah dan terkonjugasi: Dalam kasus ini pH tergantung pada PKke asam lemah.
- Buffer basa lemah dan asam terkonjugasi: Dalam kasus ini, pH tergantung pada PKB lemah.
- Buffer Garam Asam Poliprotik: Dalam beberapa kasus baik peran asam lemah dan basa konjugat keduanya garam dari netralisasi parsial asam yang memiliki beberapa proton seperti asam sulfat atau fosfat.
Menurut pH terakhirnya:
Bergantung pada keasaman atau konstanta dasar, larutan buffer dapat mengatur pH di sekitar rentang pH yang berbeda, sehingga menimbulkan tiga jenis buffer:
- Buffer asam: Adalah yang mengatur pH di sekitar nilai lebih rendah dari 7. Mereka disiapkan dengan asam lemah yang PK yangke menjadi kurang dari 7 atau dengan basis lemah yang PK yangB menjadi lebih besar dari 7.
- Buffer Netral: Adalah yang mengatur pH sekitar 7. Mereka biasanya terdiri dari asam atau basa lemah yang memiliki PKke atau pkB mendekati 7.
- Buffer alkali: Adalah nilai -nilai pH seputar nilai yang lebih besar dari 7. Mereka disiapkan dengan asam lemah yang PK yangke menjadi lebih besar dari 7 atau dengan basis lemah yang PK yangB kurang dari 7.
Contoh penyangga atau solusi redaman
Buffer asam asetat/natrium asetat
Ini adalah buffer asam lemah (asam asetat) dan garam basa konjugat (natrium asetat). Keseimbangan yang terlibat dan konstanta keseimbangannya adalah:
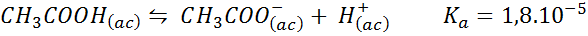
Buffer ini mengatur pH di sekitar 4.74.
Buffer amonia/amonium klorida
Ini adalah buffer basa yang lemah (amonia atau amonium hidroksida) dan garam asam terkonjugasi (amonium klorida). Keseimbangan yang terlibat dan konstanta keseimbangannya adalah:
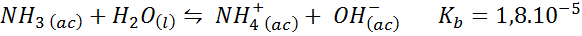
Ini adalah buffer alkali yang mengatur pH di sekitar 9.26.
Buffer bisulfat/sulfat
Dalam hal ini, ion bisulfat memainkan kertas asam lemah yang basa konjugatnya adalah ion sulfat. Keseimbangan yang terlibat adalah:
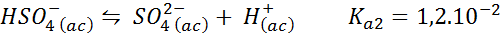
Ini adalah larutan daming asam yang mengatur pH di sekitar 3.05.
Buffer asam karbonat/bikarbonat
Ini adalah salah satu sistem regulasi pH terpenting dalam darah kita. Reaksi yang terlibat adalah: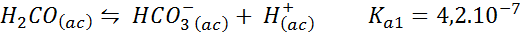
Buffer ini mengatur pH di sekitar 6.38.
Dihydrogen buffer fosfat/hidrogen fosfat
Ini adalah salah satu sistem regulasi pH yang paling banyak digunakan dalam biologi dan biokimia, karena memungkinkan untuk mengatur pH yang sangat dekat dengan pH fisiologis yang sebagian besar reaksi kimia dalam sel terjadi. Reaksinya adalah:
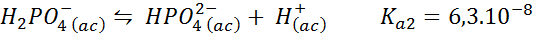
Buffer ini mengatur pH di sekitar 7.20.

