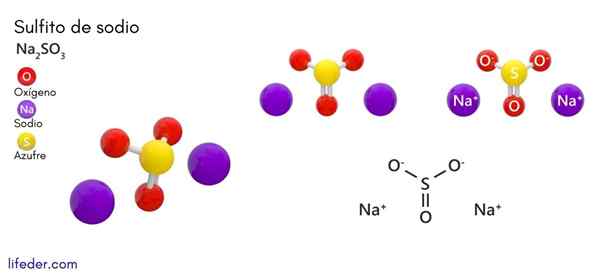
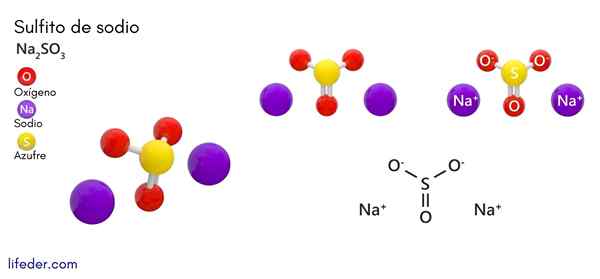
Sodium sulphite (Na2SO3)
- 4612
- 1147
- Tommie Smith
Apa itu natrium sulfit?
Dia Sodium sulfit atau natrium sulfit, yang formula kimianya adalah Na2Sw3, Ini adalah garam natrium terlarut yang diperoleh sebagai produk reaksi asam sulfur (atau sulfur oksida (IV)) dengan natrium hidroksida.
Antara 1650 dan 1660, Glauber mulai memproduksi natrium sulfit dari garam biasa (NaCl) dan asam sulfat pekat. Proses ini dianggap sebagai awal dari industri kimia.
Proses sulfit menghasilkan bubur kayu, yang diamati sebagai serat selulosa yang hampir murni dengan menggunakan beberapa garam asam sulfur untuk mengekstraksi lignin serpihan kayu.
Dengan demikian, sulfit memiliki sejumlah besar aplikasi dari berbagai jenis, termasuk dalam industri makanan sebagai aditif. Di antara fungsinya yang paling relevan, kecoklatan enzimatik dan non -enzymatic, kontrol dan penghambatan pertumbuhan mikroba, pencegahan rooting oksidatif dan modifikasi sifat reologi makanan.
Persiapan Sodium Sulphite
Secara umum, pada skala laboratorium, natrium sulfit terjadi dari reaksi larutan natrium hidroksida dengan gas sulfur dioksida (2NAOH + SO2 → Na2Sw3 + H2SALAH SATU).
Kemudian evolusi SO2 Dengan menambahkan beberapa tetes asam klorida terkonsentrasi, itu akan menunjukkan apakah natrium hidroksida hampir hilang, berubah menjadi natrium sulfit berair (NA2Sw3 + 2hcl → 2nacl + jadi2 + H2SALAH SATU).
Di sisi lain, senyawa kimia ini diperoleh secara industri dengan bereaksi sulfida dioksida dengan larutan natrium karbonat.
Dapat melayani Anda: notasi spektralKombinasi awal menghasilkan natrium bisulfit (Nahso3), Bahwa dengan bereaksi dengan natrium hidroksida atau natrium karoksida, itu diubah menjadi natrium sulfit. Reaksi ini dapat diringkas dalam reaksi global2 + Na2BERSAMA3 → Na2Sw3 + BERSAMA2.
Struktur kimia
Semua bentuk natrium sulfit ditandai dengan menjadi putih, kristal dan padatan higroskopis, yang memiliki kemampuan untuk dengan mudah menarik dan menahan molekul air dari lingkungan sekitar.
Jenis struktur kristal terkait dengan adanya air dalam senyawa. Sodium sulfit anhidrida menyajikan struktur ortorombik atau heksagonal dan, jika ada adanya molekul air dalam senyawa, mengubah strukturnya (misalnya, natrium sulfit heptahidrat menyajikan struktur monoklinik).
Properti
Spesies ini memiliki sifat fisik dan kimia tertentu yang membedakannya dari garam lain, yang dijelaskan di bawah ini:
Sifat kimia
Sebagai larutan air jenuh, zat ini memiliki perkiraan pH 9. Selain itu, solusi yang terpapar udara akhirnya mengoksidasi natrium sulfat.
Di sisi lain, jika natrium sulfit larutan berair dibiarkan mengkristal pada suhu kamar atau lebih rendah, ia melakukannya sebagai hepthidrate. Heptahydrats kristal berkuasa di udara panas dan kering, mereka juga teroksidasi di udara untuk membentuk sulfat.
Dalam hal ini, bentuk anhidra jauh lebih stabil terhadap oksidasi udara. Sulfit tidak sesuai dengan asam, oksidan yang kuat dan suhu tinggi. Itu juga tidak larut dalam amonia dan klorin.
Dapat melayani Anda: alkohol isopropilProperti fisik
Anhidrid Sodium Sulphite memiliki massa molar 126,43 g/mol, kepadatan 2.633 g/cm3, Titik fusi 33,4 ° C (92,1 ° F atau 306,5 K), titik didih 1,429 ° C (2.604 ° F atau 1.702 K), dan tidak mudah terbakar. Juga, kelarutan (diukur pada suhu 20 ° C) adalah 13,9 g/100 ml.
Penggunaan/Aplikasi
Karena sifatnya yang reaktif, natrium sulfit sangat fleksibel dan saat ini menggunakan jenis industri secara luas.
- Ini banyak digunakan dalam pengolahan air dan penghapusan oksigen terlarut dalam boiler air.
- Ini juga memiliki aplikasi di industri kertas (pulp semi -kid).
- Dalam fotografi digunakan dalam pembuatan pengungkapan.
- Dalam tingkat yang tepat digunakan dalam konservasi makanan dan antioksidan.
- Dalam industri tekstil ini digunakan dalam proses pencucian dan antikloro.
- Ini juga digunakan sebagai agen pereduksi.
- Selain itu, digunakan dalam pemulihan sekunder sumur minyak.
- Bahkan digunakan dalam pembuatan senyawa organik, pewarna, tinta, rayon kental dan karet.
- Ini digunakan dalam pembuatan banyak bahan kimia, termasuk kalium sulfat, natrium sulfit, natrium silikat, natrium hiposulfit dan natrium aluminium sulfat.
Risiko
Efek untuk paparan senyawa
Paparan yang berkepanjangan atau berulang terhadap zat ini dapat menyebabkan reaksi dermatitis dan sensitivitas. Paparan sulfit sensitif, asma dan atopik.
Demikian pula, dekomposisi asam natrium sulfit dapat melepaskan asap beracun dan berbahaya sulfur oksida, termasuk sulfur dioksida, yang dapat menyebabkan kerusakan paru permanen karena paparan kronis dan akut akut.
Dapat melayani Anda: ididio 192Demikian pula, keracunan akut oleh sulfur dioksida jarang terjadi karena gas mudah terdeteksi. Sangat menjengkelkan sehingga kontak tidak dapat ditoleransi.
Di antara gejala, batuk, rumor, bersin, merobek dan kesulitan bernapas disertakan. Namun, karyawan dengan paparan tinggi yang tak terhindarkan mungkin mengalami kerusakan paru -paru yang penting dan mungkin.
Ekotoksisitas
Sodium sulfit adalah larutan non -hazardous, yang biasanya digunakan sebagai zat penurunan air residu. Konsentrasi tinggi berkontribusi terhadap permintaan oksigen kimia yang tinggi di lingkungan akuatik.
Konsumsi makanan dengan pengawet
Salah satu aditif yang dapat menyebabkan masalah pada orang sensitif adalah kelompok yang dikenal sebagai agen sulfitasi, yang mencakup beberapa aditif anorganik sulfit (E220-228), termasuk natrium sulfit (SO2).
Pada orang yang hipersensitif atau asma, konsumsi makanan dengan sulfit atau inhalasi sulfur dioksida, itu bisa menjadi racun.
Senyawa-senyawa ini bertanggung jawab atas bronch-constraint yang diterjemahkan menjadi kesulitan bernapas. Satu -satunya perawatan untuk reaksi berlebihan ini adalah menghindari makanan dan minuman yang mengandung sulfit.