Tabel Elemen Berkala
- 3157
- 568
- Leland Robel
Apa tabel periodik elemen?
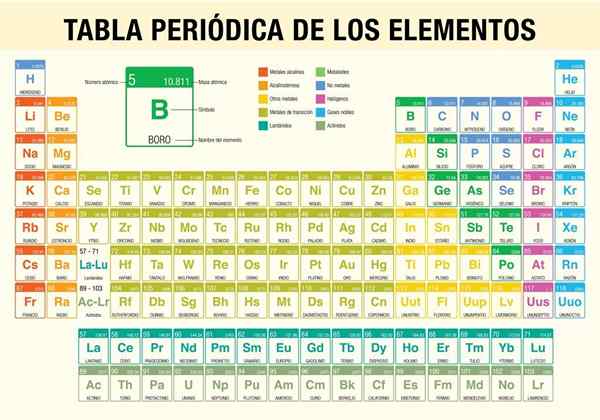
Itu Tabel Elemen Berkala Ini adalah alat yang memungkinkan Anda untuk berkonsultasi dengan sifat kimia dari 118 elemen yang dikenal sejauh ini. Sangat diperlukan saat melakukan perhitungan stoikiometrik, memprediksi sifat fisik suatu elemen, mengklasifikasikannya, dan menemukan sifat periodik di antara semuanya.
Atom menjadi lebih berat karena inti mereka menambahkan proton dan neutron, yang juga harus disertai dengan elektron baru; Jika tidak, elektroneutralitas tidak akan mungkin terjadi. Dengan demikian, beberapa atom sangat ringan, seperti hidrogen, dan lainnya, superpesado, seperti Oganerson.
Ilmuwan Dmitri Mendeléyev, yang pada tahun 1869 (hampir 150 tahun yang lalu) diterbitkan, setelah satu dekade studi teoretis dan eksperimen, tabel periodik pertama dalam upaya untuk mengatur 62 elemen yang diketahui pada waktu itu.
Untuk apa tabel periodik?
Penggunaan utama tabel adalah:
- Tahu simbol dan nama setiap elemen kimia yang ada.
- Tahu massa atom dan jumlah atom elemen.
- Menginformasikan tentang hubungan antara berbagai elemen.
- Tunjukkan tren yang berbeda (periodisitas).
- Klasifikasi jenis elemen kimia. Jenis -jenis ini termasuk logam alkali, logam dasar, logam transisi, non -logam, gas mulia, halogen, lahan alkali, semimetal, aktinid dan lantanid.
- Memprediksi sifat elemen baru yang belum ditemukan atau tidak disintesis.
Bagaimana tabel periodik diatur? (Struktur dan Organisasi)
Periode
Elemen dipesan dalam baris atau periode tergantung pada tingkat energi orbitalnya. Sebelum periode 4, ketika unsur -unsur diikuti dalam peningkatan urutan massa atom, itu adalah untuk setiap delapan dari mereka sifat kimia diulangi lagi (hukum oktaf, oleh John Newlands).
Logam transisi menyelinap ke elemen non -metalik lainnya, seperti belerang dan fosfor. Untuk alasan ini, masuknya fisika kuantum dan konfigurasi elektronik untuk pemahaman tabel periodik modern sangat penting.
Orbital dari lapisan energi diisi dengan elektron (dan inti proton dan neutron), saat bergerak selama suatu periode. Lapisan energi ini berjalan seiring dengan ukuran atom atau radio; Oleh karena itu, elemen periode yang lebih tinggi lebih kecil dari yang ditemukan di bawah ini.
H dan yang saya temukan di tingkat energi pertama (periode); baris pertama kotak abu -abu, pada periode keempat; dan deretan kotak ananjadas, di periode keenam. Perhatikan bahwa, meskipun yang terakhir tampaknya berada dalam dugaan periode kesembilan, itu sebenarnya milik keenam, tepat setelah kotak kuning BA.
Kelompok
Berkeliling periode adalah bahwa massa, jumlah proton dan elektron meningkat. Di kolom atau grup yang sama, meskipun massa dan proton bervariasi, jumlahnya Elektron Lapisan Valencia adalah sama.
Misalnya, di kolom atau grup pertama, H hanya memiliki satu elektron dalam orbital 1S1, Seperti Li (2s1), Natrium (3s1), Kalium (4s1) Dan seterusnya ke Francio (7s1). Bahwa nomor 1 menunjukkan bahwa elemen -elemen ini hampir tidak memiliki elektron valencia, dan karenanya, milik kelompok 1 (AI). Setiap elemen dalam periode yang berbeda.
Tanpa menghitung hidrogen, kotak hijau, elemen di bawahnya berasal dari kotak oranye dan disebut logam alkali. Satu lagi ke kotak kanan dalam periode apa pun, adalah grup atau kolom 2; yaitu, elemennya memiliki dua elektron valensi.
Dapat melayani Anda: kinerja teoretisTetapi ketika Anda pindah ke kanan, tanpa sepengetahuan orbital D, Anda mencapai kelompok Boro (B) atau Grup 13 (IIIA); Alih -alih Grup 3 (IIIB) atau Skandi (SC). Mempertimbangkan pengisian orbital D, periode kotak abu -abu mulai dilalui: logam transisi.
Nomor Proton vs Elektron Valencia
Saat mempelajari tabel periodik, kebingungan dapat timbul antara jumlah atom Z atau jumlah proton total dalam nukleus, dan jumlah elektron valensi. Misalnya, karbon memiliki z = 6, yaitu, ia memiliki enam proton dan oleh karena itu enam elektron (jika tidak, ia tidak bisa berupa atom dengan beban netral).
Tapi, dari enam elektron itu, Empat berasal dari Valencia. Untuk alasan itu konfigurasi elektroniknya adalah [dia] 2s22 p2. [Dia] menunjukkan kedua elektron 1s2 dari lapisan tertutup, dan secara teoritis tidak berpartisipasi dalam pembentukan tautan kimia.
Juga, karena karbon memiliki empat elektron valensi, "nyaman" terletak di kelompok 14 (PPN) dari tabel periodik.
Unsur -unsur di bawah karbon (ya, GE, SN, PB dan FL) memiliki angka atom (dan atom) yang lebih tinggi; Tetapi setiap orang memiliki kesamaan dengan empat elektron Valencia. Ini adalah kunci untuk memahami mengapa suatu elemen milik satu kelompok dan bukan yang lain.
Elemen tabel periodik
Blok s
Seperti dijelaskan, kelompok 1 dan 2 ditandai dengan memiliki satu atau dua elektron di orbital. Orbital -orbital ini adalah geometri bola, dan karena salah satu dari kelompok -kelompok ini diturunkan, unsur -unsurnya memperoleh lapisan yang meningkatkan ukuran atom mereka.
Untuk menghadirkan tren yang kuat dalam sifat kimianya dan cara bereaksi, elemen -elemen ini diatur sebagai blok S. Oleh karena itu, logam alkali dan logam alkalinery milik blok ini. Konfigurasi elektronik elemen blok ini adalah NS (1S, 2S, dll.).
Meskipun elemen helium berada di ujung kanan atas tabel, konfigurasi elektroniknya adalah 1s2 Dan karena itu milik blok ini.
Blok p
Tidak seperti blok S, elemen -elemen blok ini menghadirkan orbital yang sepenuhnya penuh, sementara orbital P mereka terus diisi dengan elektron. Konfigurasi elektronik elemen milik blok ini adalah tipe NS2Np1-6 (P orbital dapat memiliki satu atau hingga enam elektron untuk diisi).
Jadi di bagian mana dari tabel periodik adalah blok ini? Di sebelah kanan: kotak hijau, tempat tinggal dan biru; Yaitu, elemen non -metalik dan logam berat, seperti bismuth (bi) dan timah (pb).
Dimulai dengan boron, dengan konfigurasi elektronik NS2Np1, Karbon di sebelah kanan Anda menambahkan elektron lain: 2s22 p2. Kemudian, konfigurasi elektronik dari elemen lain dari periode 2 blok p adalah: 2s22 p3 (nitrogen), 2s22 p4 (oksigen), 2s22 p5 (fluoride) dan 2s22 p6 (neon).
Jika periode yang lebih rendah diturunkan, tingkat energi 3: 3 akan memiliki23p1-6, Dan seterusnya sampai akhir blok P.
Perhatikan bahwa hal terpenting di blok ini adalah bahwa, dari periode 4, elemen -elemennya telah sepenuhnya mengisi orbital (kotak biru ke kanan). Singkatnya: blok S adalah di sebelah kiri tabel periodik, dan blok p, ke kanan.
Elemen perwakilan
Apa elemen yang representatif? Mereka adalah mereka yang di satu sisi dengan mudah kehilangan elektron, atau di sisi lain, mereka memenangkan mereka untuk menyelesaikan oktet Valencia. Dengan kata lain: mereka adalah elemen blok s dan p.
Dapat melayani Anda: pengemulsi: proses emulsi, aspek molekuler, aplikasiKelompok mereka membedakan diri dari orang lain melalui huruf A di akhir. Jadi, ada delapan kelompok: dari AI ke VIIIA. Tetapi saat ini, sistem penomoran yang digunakan dalam tabel periodik modern adalah bahasa Arab, dari 1 hingga 18, termasuk logam transisi.
Karena alasan itu kelompok Boro mungkin IIIA, atau 13 (3+10); kelompok karbon, PPN atau 14; dan gas mulia, yang terakhir di sebelah kanan meja, VIIIA atau 18.
Logam transisi
Logam transisi adalah semua elemen kotak abu -abu. Sepanjang menstruasi, orbital mereka diisi, yaitu lima dan karenanya dapat memiliki sepuluh elektron. Karena sepuluh elektron harus mengisi orbital, maka harus ada sepuluh kelompok atau kolom.
Masing -masing kelompok ini dalam sistem penomoran lama ditetapkan dengan nomor Romawi dan huruf B di akhir. Kelompok pertama, yaitu skandi, adalah IIIB (3), besi, kobalt dan nikel VIIIB karena memiliki reaktivitas yang sangat mirip (8, 9 dan 10), dan seng IIB (12).
Seperti yang dapat dilihat, jauh lebih mudah untuk mengenali kelompok dengan angka Arab daripada menggunakan nomor Romawi.
Logam transisi internal
Dari periode 6 tabel periodik, orbital f mulai tersedia secara energik. Ini harus diisi lebih dulu dari orbital D; Dan karena itu, elemen -elemennya biasanya terpisah agar tidak terlalu banyak memperpanjang meja.
Dua periode terakhir, oranye dan keabu -abuan. Ada tujuh orbital F, yang membutuhkan empat belas elektron untuk diisi, dan karenanya, harus ada empat belas kelompok.
Jika kelompok -kelompok ini ditambahkan ke tabel periodik, akan ada total 32 (18 + 14) dan akan memiliki versi "memanjang":
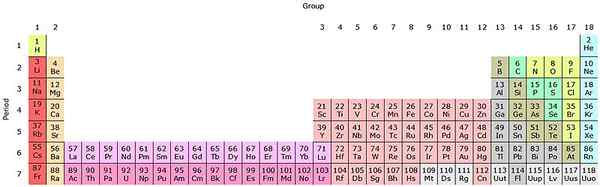 Sumber: oleh SandBH [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)], dari Wikimedia Commons
Sumber: oleh SandBH [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)], dari Wikimedia Commons Baris merah muda jernih sesuai dengan lantanoides, sedangkan baris merah muda gelap aktinoid. Lantano, dengan z = 57, actinio, ac with z = 89, dan seluruh blok F termasuk dalam kelompok skandi yang sama. Karena? Karena skandi memiliki orbital dan1, yang ada di seluruh lantanoides dan aktinoid.
Dan AC memiliki pengaturan 5D Valencia16s2 dan 6d17S2. Saat Anda bergerak tepat di kedua baris, orbital 4F dan 5F mulai terisi. Setelah penuh, Anda mencapai elemen Luthacio, Lu, dan Laurencio, LR.
Logam dan non -logam
Meninggalkan kue meja periodik di belakang, lebih nyaman untuk menggunakan gambar superior, bahkan dalam bentuknya yang memanjang. Saat ini sebagian besar elemen yang disebutkan di atas adalah logam.
Pada suhu kamar, semua logam adalah zat padat (kecuali merkuri, yang cair) abu -abu perak (kecuali untuk tembaga dan emas). Mereka juga biasanya keras dan cemerlang; Meskipun blok S lembut dan rapuh. Elemen -elemen ini ditandai dengan kemudahan kehilangan elektron dan membentuk kation m+.
Dalam kasus lantanoid, tiga elektron kehilangan 5D16s2 Menjadi kation trivalen m3+ (seperti dia3+). Bukit, sementara itu, mampu kehilangan empat elektron (CE4+).
Di sisi lain, elemen non -metalik merupakan bagian paling tidak dari tabel periodik. Mereka adalah gas atau padatan dengan atom yang terkait secara kovalen (seperti belerang dan fosfor). Semua terletak di blok P; Lebih tepatnya, di bagian atasnya, karena turun ke periode bawah meningkatkan karakter logam (BI, PB, PO).
Selain itu, non -logam alih -alih kehilangan elektron, memenangkannya. Dengan demikian, mereka membentuk anion x- Dengan beban negatif yang berbeda: -1 untuk halogen (kelompok 17), dan -2 untuk kalkogen (kelompok 16, oksigen).
Dapat melayani Anda: etil alkohol: struktur, sifat, penggunaan, mendapatkanKeluarga Logam
Di dalam logam ada klasifikasi internal untuk membedakan mereka dari:
- Logam Grup 1 adalah basa.
- Grup 2, Alkalinerrior Metals (SR. Scholambara).
- Kelompok 3 (IIB) Keluarga Skandi. Keluarga ini terdiri dari skandi, kepala kelompok, dari Ititrium dan, dari Lantano, Actinio, dan semua Lantanoides dan Actinoides.
- Kelompok 4 (IVB), Keluarga Titanium: TI, ZR (Circonium), HF (Hafnio) dan RF (Rutherfordio). Berapa banyak elektron valencia? Jawabannya ada di grup Anda.
- Grup 5 (VB), Keluarga Vanadio. Grup 6 (VIB), Keluarga Chrome. Dan seterusnya ke keluarga seng, Grup 12 (IIB).
Metaloid
Karakter logam meningkat dari kanan ke kiri, dan dari atas ke bawah. Tapi apa perbatasan antara kedua jenis elemen kimia ini? Perbatasan ini terdiri dari unsur -unsur yang dikenal sebagai metaloid, yang memiliki karakteristik logam dan non -logam.
Metalloids dapat dilihat di meja periodik di "tangga" yang dimulai dengan boron, dan berakhir di elemen radioaktif astato. Elemen -elemen ini adalah:
- B: Boro.
- Silikon: Ya.
- GE: Germanio.
- AS: Arsenik.
- SB: Antimon.
- TE: Telurio.
- AT: Astato.
Masing -masing dari tujuh elemen ini menunjukkan sifat menengah, yang bervariasi sesuai dengan lingkungan atau suhu kimia. Salah satu sifat ini adalah semikonduksi, yaitu, metaloid adalah semikonduktor.
Gas
Di bawah kondisi terestrial, unsur gas adalah logam non -cahaya, seperti nitrogen, oksigen dan fluorin. Juga, gas klorin, hidrogen dan mulia memasuki klasifikasi ini. Dari mereka semua, yang paling simbolis adalah gas mulia, karena kecenderungannya yang rendah untuk bereaksi dan berperilaku seperti atom bebas.
Yang terakhir ditemukan di kelompok 18 dari tabel periodik dan adalah:
- Helio, dia.
- Neon, ne.
- Argon, AR.
- Kripton, Kr.
- Xenón, xe.
- Radón, Rn.
- Dan yang terbaru, gas oganese sintetis yang mulia, OG.
Semua gas mulia memiliki kesamaan konfigurasi valencia ns2Np6; yaitu, mereka telah menyelesaikan oktet Valencia.
Agregasi menyatakan suhu lain
Elemen dalam keadaan padat, cair atau gas tergantung pada suhu dan kekuatan interaksi mereka. Jika suhu bumi dingin sampai nol absolut (0k) ada, maka semua elemen akan membeku; Kecuali helium, yang akan mengembun.
Pada suhu ekstrem ini, sisa gas akan dalam bentuk es.
Di sisi lain, jika suhunya sekitar 6000 ribu, "semua" elemen akan berada dalam keadaan gas. Dalam kondisi ini, awan emas, perak, timah dan logam lainnya dapat diamati secara harfiah.
Pentingnya tabel periodik
Saat ini, tabel periodik adalah instrumen organisasi kimia yang paling penting karena hubungan terperinci dari elemen -elemennya. Penggunaannya sangat penting untuk siswa dan guru dan untuk peneliti dan banyak profesional yang didedikasikan untuk cabang kimia dan teknik.
Dengan hanya melihat tabel periodik, jumlah yang sangat besar dan informasi diperoleh dengan cepat dan efektif, seperti:
- Lithium (Li), berilium (BE) dan boron (b) Menghasilkan listrik.
- Lithium adalah logam basa, berilium adalah logam alkaline dan boron bukanlah logam.
- Lithium adalah pendorong terbaik dari tiga bernama, diikuti oleh berilium dan, akhirnya, boron (semikonduktor).
Dengan demikian, dengan menemukan unsur -unsur ini dalam tabel periodik, kecenderungan konduktivitas listrik dapat langsung disimpulkan.