Teori orbital molekuler

- 4861
- 847
- Ernesto Mueller
Apa itu teori orbital molekuler?
Itu Teori orbital molekuler (TOM) Ini adalah model matematika yang dikembangkan untuk menjelaskan sifat fisikokimia molekul, seperti penyerapan dan emisi radiasi, konduktivitas listrik, serta sifat elektronik dari hubungannya. Ini mempertimbangkan, tidak seperti Valencia Link Theory (TEV), bahwa elektron dipindahkan ke seluruh molekul, tanpa secara probabilistik terletak di tautan.
Oleh karena itu, teori orbital molekuler menerapkan prinsip -prinsip kuantum yang sama yang menentukan fungsi gelombang untuk orbital atom, sehingga menggambarkan keadaan energi elektron dalam atom; Hanya sekarang, membahas orbital molekul yang disebut SO, berasal dari kombinasi linier orbital atom atom yang terhubung.
 Paramagnetisme oksigen cair, dan oleh karena itu daya tariknya untuk magnet, dijelaskan berkat teori orbital molekuler. Sumber: Pieter Kuipeper via Wikipedia.
Paramagnetisme oksigen cair, dan oleh karena itu daya tariknya untuk magnet, dijelaskan berkat teori orbital molekuler. Sumber: Pieter Kuipeper via Wikipedia. Teori orbital molekuler bekerja kemudian, bekerja dengan orbital molekul, distribusi elektronik dan spasialnya, serta diagram energi masing -masing, yang memungkinkan mengamati celah energi yang memisahkan mereka. Di atas segalanya, jelaskan paramagnetisme zat tertentu, seperti oksigen molekuler dalam keadaan cair (lihat di atas).
O2, Digambarkan oleh struktur Lewis dan teori tautan Valencia, ia memiliki semua elektron berpasangan, jadi secara teori itu harus diamagnetik. Namun, dalam praktiknya telah ditunjukkan bahwa itu sebenarnya paramagnetik, yaitu, ia memiliki elektron yang hilang; khususnya sepasang elektron yang hilang.
Dari konstruksi diagram OM (orbital molekul) untuk O2, Molekul diatomik homonuklear, dapat dilihat bahwa akan ada dua elektron yang hilang energi tinggi. Bukan hanya ini, tetapi putaran dan posisi elektron -elektron ini dalam OMS juga menjelaskan keadaan elektronik lain dari atau2 (lajang).
Kemenangan lain yang paling penting dari teori orbital molekuler adalah membantu memprediksi kemungkinan keberadaan molekul diatomik, serta stabilitas relatifnya. Dengan demikian, teori orbital molekul benar dalam prediksi molekul seperti B2 dan li2, Bahkan ketika mereka hanya dapat mendeteksi dalam fase uap pada suhu tinggi. Juga, teori ini menolak keberadaan hipotetis yang saya miliki2 atau ne2.
Jenis ikatan dan orbital molekuler
Seperti halnya teori Link Valencia, dalam teori orbital molekuler, beberapa jenis tautan dipertimbangkan tergantung pada arah tumpang tindih orbital atom yang berpartisipasi dalam ikatan kimia. Di antara yang paling penting dan hadir dalam sifat molekuler, kami memiliki ikatan sigma dan pi.
Sigma
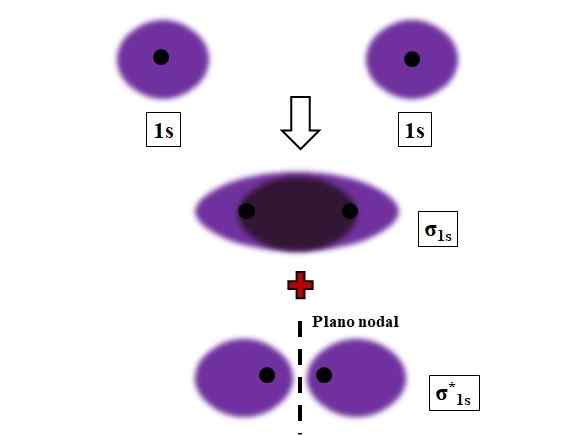 Formasi σ1s dan σ1s* tautan selama tumpang tindih dua orbital atom 1s. Sumber: Gabriel Bolívar.
Formasi σ1s dan σ1s* tautan selama tumpang tindih dua orbital atom 1s. Sumber: Gabriel Bolívar. Sigma, ikatan σ ditetapkan ketika orbital atom tumpang tindih secara frontal, dalam kaitannya dengan kapak internuclear imajiner.
Pertimbangkan, misalnya, tautan σ yang terbentuk ketika dua orbital atom 1S, menurut atom hidrogen, dekat dengan jarak yang sangat pendek (gambar di atas). Karena orbital 1S bersifat simetris, tumpang tindih mereka akan selalu menjadi frontal; Oleh karena itu, mereka akan selalu menghasilkan orbital molekul σ1s dan σ1s*.
Perhatikan sekarang orbital molekul σ1s menunjukkan kepadatan elektronik yang terkonsentrasi di ruang yang memisahkan dua inti. Ini berarti bahwa dalam orbital σ1s Probabilitas menemukan elektron maksimal di wilayah molekul ini. Elektron σ1s Mereka dipindahkan ke seluruh ruang yang menutupi warna ungu.
Di sisi lain, di orbital σ1s* Kami memiliki bidang nodal antara dua inti. Ini berarti bahwa probabilitas menemukan elektron antara ruang itu sama dengan nol. Perhatikan bahwa di orbital σ1s* Elektron menggambarkan posisi di sekitar masing -masing dari dua inti; tidak di sekitar molekul secara keseluruhan.
Dapat melayani Anda: Radio: Struktur, Properti, Penggunaan, MemperolehPi
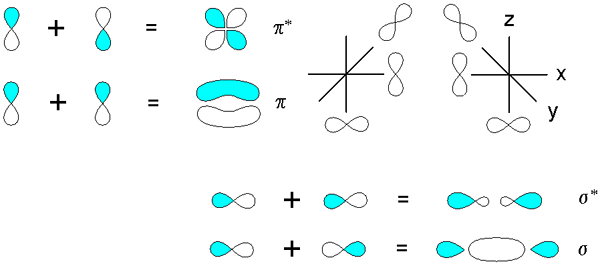 Ikatan sigma dan pi berasal dari tumpang tindih orbital p. Sumber: v8rik at in.Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Ikatan sigma dan pi berasal dari tumpang tindih orbital p. Sumber: v8rik at in.Wikipedia, CC BY-SA 3.0, via Wikimedia Commons Pertimbangkan sekarang ikatan dan orbital molekuler. Ini terjadi ketika tumpang tindih orbital terjadi dalam arah tegak lurus terhadap sumbu internuklear, yang secara sewenang -wenang difiksasi di salah satu sumbu bidang Cartesius. Dengan asumsi kita berbicara tentang orbital 2pX, Orbital 2pDan Ini akan bebas untuk membuat tautan PI (lihat lobus biru dan putih).
Saat dua orbital 2pDan Dua orbital molekuler berasal: π2py dan π2py*; Yang pertama memiliki kepadatan elektronik tertinggi dan di bawah sumbu internuclear, sedangkan yang kedua menyerupai bunga empat -metal, di mana probabilitas menemukan elektron jauh lebih rendah.
Di sisi lain, orbital 2p, untuk mengatakan 2pX, Mereka juga dapat tumpang tindih secara frontal untuk berasal dari ikatan σ dan dua orbital molekul σ2px dan σ2px*. Seperti dalam kasus σ1s dan σ1s*, Orbital σ2px menunjukkan kepadatan elektronik yang lebih besar antara kedua inti; yang bertentangan dengan σ2px*, di mana elektron berorientasi pada sisi luar.
Tautan
Orbital molekul linding adalah yang berkontribusi pada stabilitas molekul. Artinya, mereka harus memiliki lebih sedikit energi dibandingkan dengan orbital atom atom individu sebelum menghubungkan dan membentuk molekul. Dalam orbital ini elektron dipindahkan oleh semua dimensi molekul secara keseluruhan.
Dalam diagram OM, ini akan selalu terletak di bawah orbital atom yang digabungkan untuk membentuknya. Ini akan terlihat lebih rinci di bagian berikutnya.
Anti -hut
Orbital molekul anti -housing, di sisi lain, adalah mereka yang mengacaukan molekul. Mereka dilambangkan dengan tanda bintang (*), dan energinya lebih tinggi dari orbital atom yang berasal dari mereka. Dalam orbital ini, elektron dipindahkan secara tidak teratur, seolah -olah molekulnya terfragmentasi secara elektronik.
Dalam diagram OM, mereka akan selalu terletak di atas orbital atom yang digabungkan untuk membentuknya.
Tidak ditautkan
Sementara itu, orbital non -tautan, serta elektronnya, adalah mereka yang tidak berkontribusi atau membahayakan stabilitas molekul. Energi -energinya sangat mirip dengan orbital atom.
Pesanan tautan
Urutan tautan menjadi dalam teori orbital molekuler, seperti angka tautan dalam teori tautan valencia: ukuran gaya tautan dalam molekul. Dengan demikian, urutan tautan yang sama dengan 1 sesuai dengan tautan sederhana (-). Dan pesanan tautan (atau.e) sama dengan 2, sesuai dengan ikatan rangkap (=). Segera.
Pesanan ini ditentukan dari penghitungan elektron dalam diagram OM untuk molekul tertentu. Untuk melakukan ini, formula berikut harus diterapkan:
salah satu.E = (Jumlah Elektron Tertaut - Jumlah Elektron Anti -hut)/2
Link elektron berkontribusi pada molekul untuk stabil, sementara elektron anti -fiery mengacaukannya. Oleh karena itu, semakin banyak elektron anti -sung, semakin kecil atau.E, dan molekulnya akan cenderung sangat tidak stabil. Saat o.E sama dengan 0, itu berarti bahwa molekul tidak ada (atau setidaknya secara teori).
OM Diagram
Dalam diagram OM, energi orbital molekuler diwakili, dan pengisian elektroniknya juga divisualisasikan, yang mematuhi aturan Aufbauf dan Sinn, serta prinsip pengecualian Pauling. Pertimbangkan, misalnya, dua diagram berikut:
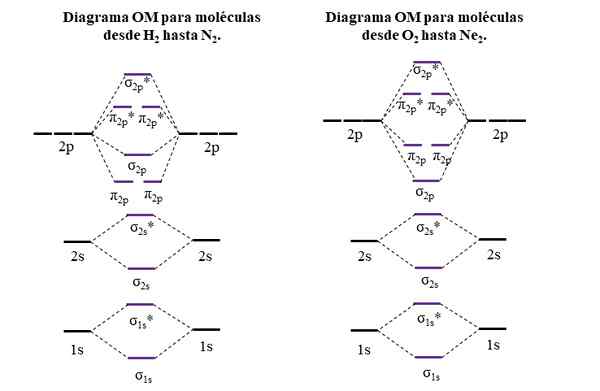 OM Diagram untuk molekul periode pertama dan kedua dari tabel periodik. Sumber: Gabriel Bolívar.
OM Diagram untuk molekul periode pertama dan kedua dari tabel periodik. Sumber: Gabriel Bolívar. Garis horizontal di sisi, hitam, mewakili energi orbital atom. Sebaliknya, garis horizontal pusat, ungu, adalah energi orbital molekul. Perhatikan bagaimana penghubung dan anti -agen didistribusikan (*) sehubungan dengan orbital atom atom individu.
Itu dapat melayani Anda: grup amino (NH2): struktur, properti, contohPerhatikan juga bahwa di diagram kanan, om σ2 p Mereka mengubah tempat dengan π2 p. Ini terjadi dengan molekul O2, F2, dan ne hipotetis2.
Contoh
Dalam contoh -contoh berikut, OM akan melanjutkan dengan elektron, menghitung urutan tautan, dan membuat prediksi pada gaya ikatan atau stabilitas molekul yang dimaksud.
H2
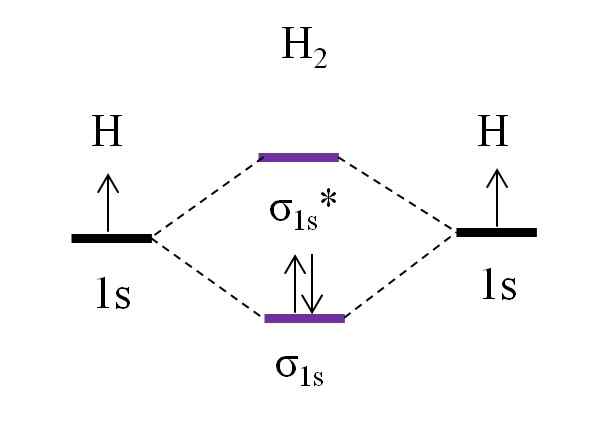 OM Diagram untuk molekul dihydrogen. Sumber: Gabriel Bolívar.
OM Diagram untuk molekul dihydrogen. Sumber: Gabriel Bolívar. Dimulai dengan molekul paling sederhana, yaitu dihydrogen, h2, Dua atom H dihubungkan dengan menggabungkan dua orbital atom 1s untuk membentuk dua orbital molekul σ1s dan σ1s*. Dua elektron kemudian melanjutkan untuk mengisi orbital molekul.
Pertama orbital σ diisi1s, Karena itu adalah energi terkecil (aturan aufbauf). Kemudian, elektron kedua harus selesai mengisi orbital σ1s Sebelum memanjat orbital σ1s* (Aturan wastafel). Dan akhirnya, elektron kedua ini memandu putarannya ke arah yang berlawanan dengan elektron pertama (prinsip pengecualian Pauling). Dengan demikian, kedua elektron terletak di orbital σ tertaut1s.
Bagaimana dengan urutan tautan? Di orbital molekul tautan σ1s Kami memiliki 2 elektron; Sementara dalam orbital molekul anti -hell σ1s* Kami tidak memilikinya. Oleh karena itu, perhitungannya adalah:
salah satu.E = (2-0)/2
= 1
Menjadi atau.Dan sama dengan 1, itu berarti bahwa tautan yang menyatukan dua atom hidrogen sederhana: h-h. Secara umum, jika nilai ini sama dengan atau lebih besar dari 1, dikatakan bahwa molekul ada dan stabil.
Dia2
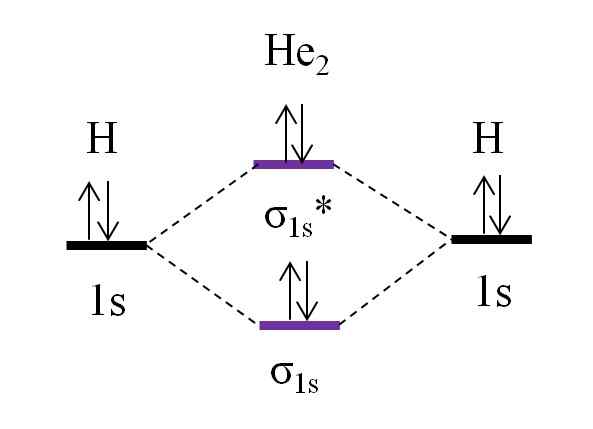 OM Diagram untuk molekul dihelio hipotetis. Sumber: Gabriel Bolívar.
OM Diagram untuk molekul dihelio hipotetis. Sumber: Gabriel Bolívar. Sekarang misalkan Anda memiliki molekul dia2. Di atas kita melihat bahwa diagram OM -nya sangat mirip dengan H2, Dengan 2 elektron tambahan yang terletak di orbital σ1s*. Ketika ada total 4 elektron yang menambahkan dua atom, maka harus ada 4 elektron di semua orbital molekul yang dihasilkan.
Menentukan o.E untuk i he2 kami akan memiliki:
salah satu.E = (2-2)/2
= 0
Ini berarti bahwa tidak ada tautan yang mungkin bahwa dua atom helium. Faktanya, sampai saat ini keberadaan molekul ini belum diidentifikasi, yang setuju dengan prediksi teori orbital molekuler.
B2
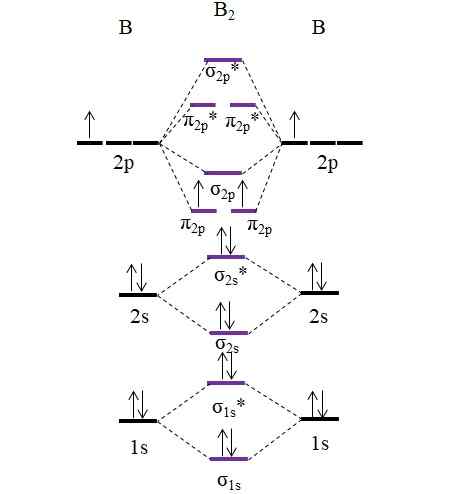 OM Diagram untuk molekul B2. Sumber: Gabriel Bolívar.
OM Diagram untuk molekul B2. Sumber: Gabriel Bolívar. Perhatikan bahwa dalam pembentukan orbital molekuler, elektron lapisan internal juga diperhitungkan; Tidak hanya orang -orang Valencia.
Jadi, dalam contoh molekul diboro, b2, Setiap atom boron menyumbang 5 elektron secara total, 3 di antaranya berasal dari Valencia; Ini adalah, orbital 2p dan 2p mereka. Dua elektron orbital 2p diposisikan dalam orbital molekul yang berbeda π2 p Dengan duri paralel (aturan wastafel).
Kami kemudian melanjutkan untuk menghitung urutan tautan:
salah satu.E = (6-4)/2
= 1
Oleh karena itu, molekul ini diharapkan memiliki tautan B-B sederhana. B2 Ini adalah molekul yang hanya ada dalam tahap uap pada suhu yang sangat tinggi, karena boron dalam kondisi normal mengadopsi struktur dan desain jaringan yang lebih kompleks.
C2 dan C22-
Pertimbangkan pertama diagram OM untuk molekul C2:
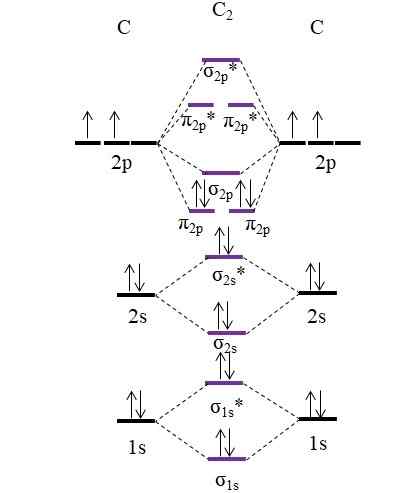 OM Diagram untuk molekul C2. Sumber: Gabriel Bolívar.
OM Diagram untuk molekul C2. Sumber: Gabriel Bolívar. Sekarang, dua elektron baru yang disediakan oleh atom karbon diposisikan lagi dalam orbital molekul π2 p Tetapi dengan putaran yang berlawanan (prinsip eksklusi Pauling).
Menentukan pesanan tautan Anda yang akan kami miliki:
salah satu.E = (8-4)/2
= 2
Perhatikan bahwa orbital molekul π2 p Tambahkan 4 ikatan elektron ke formula. Menjadi urutan ini sama dengan 2, itu berarti molekul C2 Ini memiliki ikatan rangkap, c = c. Sekali lagi, molekul C2, Juga disebut karbon diatomik, hanya ada fase uap pada suhu tinggi, dan itu adalah salah satu bentuk alotropik karbon paling sederhana.
Dan bagaimana dengan C22-? Diagram OM Anda adalah sebagai berikut:
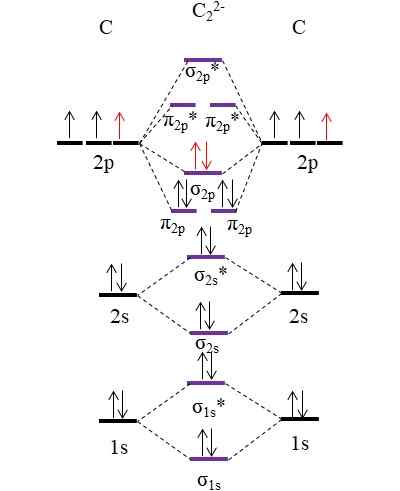 OM Diagram untuk Anion C22-. Sumber: Gabriel Bolívar.
OM Diagram untuk Anion C22-. Sumber: Gabriel Bolívar. Dua elektron baru (panah merah) diposisikan dalam orbital molekul penghubung σ2 p. Dengan demikian ini mengasumsikan bahwa setiap atom karbon berkontribusi salah satu dari dua muatan negatif (untuk keadaan oksidasi -1).
Dapat melayani Anda: Merkurius Fulminat: Struktur, Properti, Memperoleh, PenggunaanMenghitung pesanan tautan Anda yang akan kami miliki:
salah satu.E = (10-4)/2
= 3
Yaitu anion c22-, Juga disebut anion acetyluro, ia memiliki triple link, [cop]2-. Ini adalah anion yang relatif stabil dengan gaya tautan yang hebat; Namun, tergantung pada ion mitranya, ia dapat berasal dari senyawa eksplosif.
N2 dan N2+
Molekul nitrogen yang terkenal, n2, Ini juga dapat dijelaskan dengan sempurna dengan menggunakan diagram orbital molekuler:
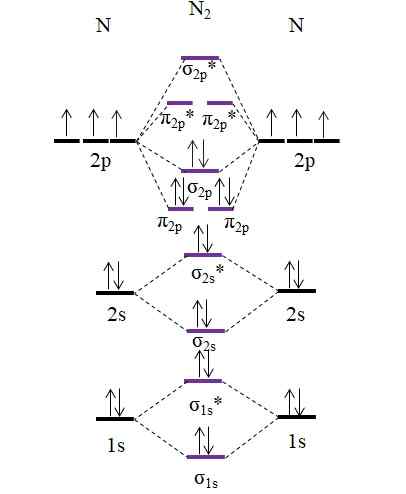 OM Diagram untuk molekul N2. Sumber: Gabriel Bolívar.
OM Diagram untuk molekul N2. Sumber: Gabriel Bolívar. Perhatikan bahwa diagram ini persis sama dengan untuk anion c22-. Ini berarti n2 dan C22- Mereka isolektronik. Namun, fakta seperti itu tidak menyiratkan bahwa kedua spesies berperilaku dengan cara yang sama. Kemudian2, netral, jauh lebih stabil daripada c22-, negatif, bahkan jika keduanya memiliki urutan tautan yang sama dengan 3, nopn.
Dan bagaimana dengan kation n2+? Mari kita lihat diagram OM Anda:
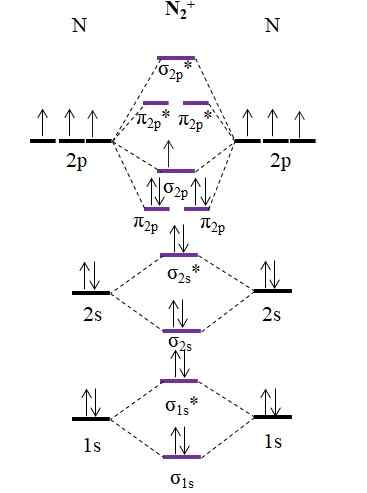 OM Diagram untuk Kation N2+. Sumber: Gabriel Bolívar.
OM Diagram untuk Kation N2+. Sumber: Gabriel Bolívar. Seperti kation n2+ Ini memiliki satu elektron lebih sedikit, ini dihapus orbital molekul σ2 p. Kemudian2 Itu diamagnetik, sedangkan n2+ Itu paramagnetik. Dan urutan tautannya adalah:
salah satu.E = (9-4)/2
= 2.5
Tautan 2 2.5 akan diwakili dengan dua baris dan satu poin. Namun, hal seperti itu tidak masuk akal dalam teori Valencia atau dalam struktur Lewis. Karena urutan tautan ini kurang dari 3, kekuatan tautan yang ada di n2+ lebih rendah dari n2, Jadi lebih tidak stabil.
SALAH SATU2, SALAH SATU22- SAYA22+
Sekarang mari kita lihat molekul lain yang sangat penting untuk hidup: oksigen molekuler atau diatomik, atau2. Menurut teori Valencia dan struktur Lewis, itu harus diamagnetik; Tetapi secara eksperimental telah terbukti paramagnetik, jadi telah menghilang elektron di suatu tempat.
Di bawah ini kami membandingkan diagram OM untuk O2 dan ion atau22- (oksida) dan o22+ (Oksidasi):
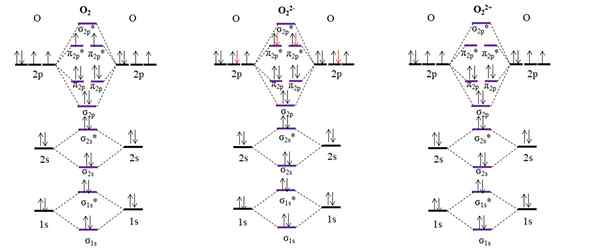 OM Diagram untuk oksigen molekuler dan dua ion utamanya. Sumber: Gabriel Bolívar.
OM Diagram untuk oksigen molekuler dan dua ion utamanya. Sumber: Gabriel Bolívar. Diagram OM untuk O2 Sampel, tidak seperti yang sebelumnya, bahwa orbital molekul σ2 p dan π2 p Ubah posisi energi mereka. Juga, kita melihat secara efektif bahwa ada dua elektron yang hilang di orbital π2 p*, yang menjelaskan karakter paramagnetik oksigen (disebutkan di awal artikel).
Di sisi lain, kami juga memiliki diagram OM untuk anion atau22-, Tersebar tak terbatas di kosmos (bulan, planet, komet, asteroid, dll.). Ini memiliki dua elektron tambahan (panah merah), yang selesai mengisi π orbital2 p*, kawin semua elektron. Akibatnya, atau22- Itu diamagnetik.
Kami juga mempertimbangkan diagram OM untuk oksidasi atau22+. Ia memiliki dua elektron kurang dari O2, meninggalkan kosong orbital π2 p*. Semua elektronnya dipasangkan, dan oleh karena itu diamagnetik.
Tautan pesanan untuk O2, SALAH SATU22- SAYA22+ Mereka masing-masing: 2 (o = o), 1 [o-o]2- dan 3 [oopo]2+. Oleh karena itu, o22+ akan memiliki tautan terkuat.
Keuntungan dan kerugian
Keuntungan
Di antara keunggulan teori orbital molekuler kita dapat mengutip yang berikut:
-Ini memungkinkan untuk mengevaluasi perintah tautan yang biasa tidak masuk akal dalam teori tautan valencia
-Ini berkorelasi baik dengan diamagnetisme dan paramagnetisme molekul
-Jarak yang memisahkan orbital molekul dalam diagram sama dengan ΔE, dan berfungsi untuk menjelaskan produk transisi elektronik dari penyerapan foton
-Berlaku tidak hanya untuk molekul diatomik homonuklear, tetapi juga untuk molekul heteronuklear, seperti CO2 dan benzena
-Ini memperluas modelnya ke jenis senyawa lain, seperti kompleks anorganik, sehingga mendukung teori bidang ligan
-Pertimbangan bahwa elektron dipindahkan di seluruh molekul lebih mudah untuk menjelaskan banyak sifat fisikokimia
Kerugian
Dan di antara beberapa kelemahan dari teori orbital molekuler yang kita miliki, untuk mengakhiri:
-Ini sangat abstrak dan membutuhkan pemahaman matematika yang mendalam untuk sepenuhnya memahaminya
-Diagram molekulasi sebagai co2, Co, h2Atau dan orang lain, mereka bisa terlalu membosankan untuk menjelaskan dan menjelaskan
-Dia tidak mengatakan apa -apa tentang daerah tertentu atau tautan molekul besar
-Juga tidak memberikan informasi mengenai geometri molekuler (bidang trigonal, bidang persegi, tetrahedral, dll.).
-Ini tidak se -grafis teori tautan Valencia
Teori orbital molekuler, sebagai kesimpulan, adalah teori yang melengkapi teori tautan valencia untuk memiliki panorama spektrum molekuler yang lebih luas dan lebih lengkap.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Teori molekuler orbital. Diperoleh dari: di.Wikipedia.org
- Stephen Lower. (7 September 2020). Teori molekuler orbital. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Steven a. Hardinger. (2017). Teori molekuler orbital. Diperoleh dari: chemed.Chem.Purdue.Edu
- Buku press. (S.F.). Bab 8: Teori Molekul Orbital. Diperoleh dari: OpenTextBC.Ac

