Pewarnaan Ziehl-Neelsen
- 1927
- 245
- Irvin Reichel
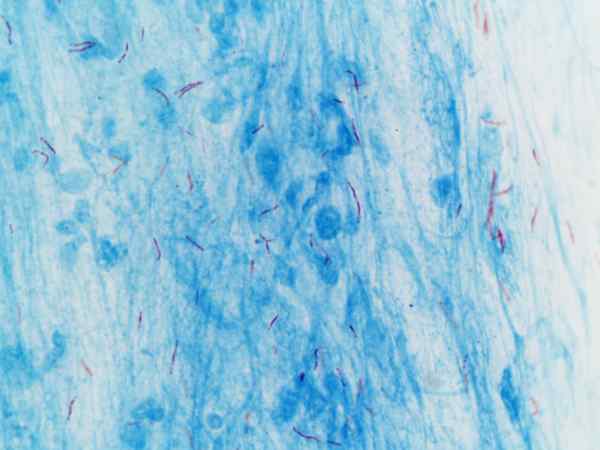
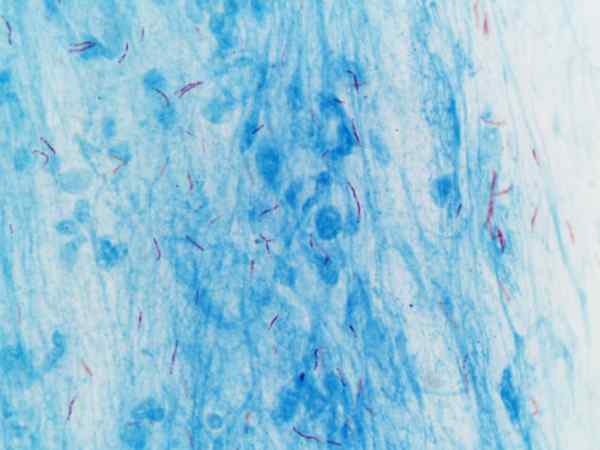 Mycobacterium tuberculosis divisualisasikan dengan pewarnaan Ziehl-Neelsen
Mycobacterium tuberculosis divisualisasikan dengan pewarnaan Ziehl-Neelsen Apa pewarnaan Ziehl-Neelsen?
Itu Pewarnaan Ziehl-Neelsen Dalam teknik pewarnaan untuk mengidentifikasi mikroorganisme asam alkohol yang resisten (AAR). Nama prosedur mikrobiologi ini mengacu pada penulisnya: bakteriologi Franz Ziehl dan ahli patologi Friedrich Neelsen.
Teknik ini adalah jenis warna diferensial, yang menyiratkan penggunaan pewarna yang berbeda untuk menciptakan kontras antara struktur yang diinginkan untuk mengamati, membedakan dan kemudian mengidentifikasi. Pewarnaan Ziehl-Neelsen berfungsi untuk mengidentifikasi jenis mikroorganisme tertentu.
Beberapa mikroorganisme ini adalah Mycobacteria (misalnya, Mycobacterium tuberculosis), Nocardias (misalnya, Nocardia sp.) dan beberapa parasit uniseluler (misalnya, Cryptosporidium parvum). Banyak bakteri dapat diklasifikasikan melalui teknik umum yang disebut pewarnaan gram.
Namun, beberapa kelompok bakteri memerlukan metode lain untuk mengidentifikasi mereka. Teknik seperti pewarnaan Ziehl-Neelsen membutuhkan kombinasi panas dengan panas untuk memperbaiki yang pertama ke dinding sel.
Kemudian muncul proses perubahan warna yang memungkinkan untuk mendapatkan dua hasil: resistensi atau sensitivitas terhadap perubahan warna dan alkohol.
Dasar
Fondasi teknik pewarnaan ini didasarkan pada sifat -sifat dinding sel mikroorganisme ini. Dinding dibentuk oleh jenis asam lemak yang disebut asam mikolat; Ini ditandai dengan menyajikan rantai yang sangat panjang.
Saat asam lemak memiliki struktur yang sangat panjang, ini dapat mempertahankan pewarna dengan lebih mudah. Beberapa genre bakteri sangat sulit untuk diwarnai dengan pewarnaan gram, karena tingginya kandungan asam mikolik dari dinding sel.
Dalam pewarnaan Ziehl-Neelsen, senyawa fenolik fuksin digunakan, pewarna dasar. Ini memiliki kemampuan untuk berinteraksi dengan asam lemak dinding sel, yaitu tekstur cerosa pada suhu kamar.
Dapat melayani Anda: monosakaridaPewarnaan dengan fuchsin carbol ditingkatkan dengan adanya panas, karena lilin meleleh dan molekul pewarnaan bergerak lebih cepat ke dinding sel.
Asam yang digunakan kemudian berfungsi untuk mengubah warna sel -sel yang tidak diwarnai karena dindingnya tidak terkait dengan pewarna; Oleh karena itu, gaya asam asam mampu menghilangkan pewarna asam. Sel-sel yang tahan terhadap perubahan warna ini disebut asam-tahan asam.
Pewarna sekunder
Setelah perubahan warna sampel, ini kontras dengan pewarna lain yang disebut pewarna sekunder. Hijau biru atau malachite hijau umumnya digunakan.
Pewarna sekunder menodai bahan latar belakang dan, akibatnya, menciptakan kontras dengan struktur yang diwarnai pada langkah pertama. Hanya sel yang berubah warna yang menyerap pewarna kedua (t-tinction) dan ambil warnanya, sedangkan sel yang tahan asam mempertahankan warna merah.
Prosedur ini sering digunakan untuk identifikasi Mycobacterium tuberculosis Dan Mycobacterium leprae, yang disebut basil asam-alkohol yang tahan.
Reagen
Pewarna primer
0,3 % fuchsin carbol digunakan (disaring). Pewarna ini dibuat dari campuran alkohol: etanol fenol (90 %) atau metanol (95 %), dan dalam campuran ini 3 gram fuchsin dasar larut.
Solusi Menghentikan
Pada langkah ini Anda dapat menggunakan larutan asam alkohol 3 % atau asam sulfat 25 %.
Pewarnaan sekunder (counter-collar)
Pewarna yang paling banyak digunakan untuk kontras dalam sampel biasanya 0,3 % metilen biru. Namun, yang lain juga dapat digunakan, seperti 0,5 % Malachite Green.
Dapat melayani Anda: timinaTeknik
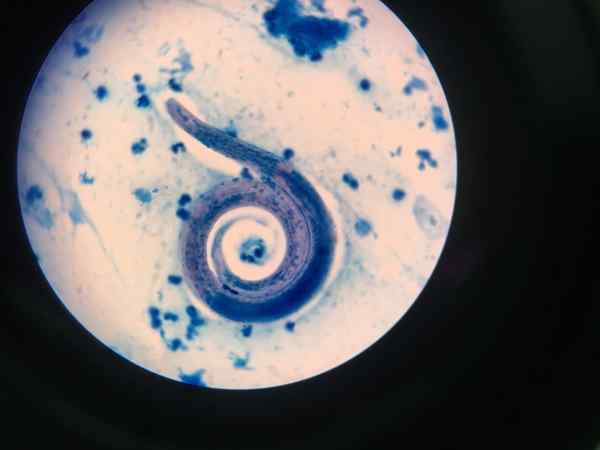 Nematoda ditampilkan dengan ziehl-neelsen
Nematoda ditampilkan dengan ziehl-neelsen Prosedur pewarnaan yang terbuka asam
Siapkan noda bakteri
Persiapan ini dilakukan pada slide yang bersih dan kering, mengikuti tindakan pencegahan sterilitas.
Pengeringan frovis
Biarkan apusan mengering pada suhu kamar.
Panaskan sampel
Sampel harus dipanaskan dengan menerapkan api ke slide di bawah. Fiksasi dengan alkohol dapat dibuat ketika bau belum disiapkan dengan dahak (diobati dengan natrium hipoklorit untuk memutarnya) dan jika tidak akan segera dicelup.
M. TBC dihilangkan dengan pemutih dan selama proses pewarnaan. Thermofixation dari sputum yang tidak diobati tidak akan membunuh M. TBC, Sedangkan fiksasi alkohol adalah bakteri.
Tutupi noda
Noda ditutupi dengan larutan fuchsin carbol (pewarnaan dasar primer).
Panaskan noda
Ini dilakukan selama 5 menit. Anda harus melihat detasemen uap (sekitar 60 ° C). Penting untuk tidak terlalu panas dan menghindari membakar sampel.
Sehubungan dengan pemanasan noda, Anda harus sangat berhati -hati saat memanaskan fuchsin carbol, terutama jika pewarnaan dilakukan pada nampan atau wadah lain di mana bahan kimia yang sangat mudah terbakar telah dikumpulkan dari pewarnaan sebelumnya sebelumnya pewarnaan sebelumnya sebelumnya.
Hanya api kecil yang harus diterapkan di bawah slide menggunakan pencahayaan swab yang sebelumnya dibasahi dengan beberapa tetes alkohol asam, metanol atau 70 % etanol. Hindari menggunakan swab besar yang direndam dalam etanol karena ini adalah risiko kebakaran.
Cuci noda
Cuci ini harus dilakukan dengan air bersih. Jika air keran tidak bersih, cuci gosok dengan air yang disaring atau disaring, sebaiknya.
Tutupi noda dengan alkohol asam
Alkohol asam ini harus 3 %. Cakupan dilakukan selama 5 menit atau sampai baunya cukup berubah warna, yaitu, merah muda pucat.
Dapat melayani Anda: epiblastHarus diperhitungkan bahwa alkohol asam mudah terbakar; Oleh karena itu, itu harus digunakan dengan sangat hati -hati. Hindari dekat dengan sumber pengapian.
Cuci noda
Cuci harus dengan air yang bersih dan suling.
Tutupi noda dengan pewarna
Ini bisa menjadi pewarnaan hijau malachite (0,5 %) atau metilen biru (0,3 %) selama 1 atau 2 menit, menggunakan waktu yang lebih keras jika baunya tipis.
Cuci noda
Air bersih (disuling) harus digunakan lagi.
Untuk menguras
Bagian belakang slide harus dibersihkan dan noda ditempatkan di rak drainase, sehingga mengering ke udara (tidak menggunakan kertas penyerap untuk pengeringan).
Periksa noda dalam mikroskop
Tujuan 100x dan minyak perendaman harus digunakan. Pindai noda secara sistematis dan tuliskan pengamatan yang relevan.
Menafsirkan hasilnya
Secara teoritis, mikroorganisme yang dicelup dari warna kemerahan dianggap asam alkohol positif (AAR+).
Sebaliknya, jika mikroorganisme dicelup biru atau hijau, tergantung pada pewarna yang digunakan sebagai kontra-kerah, mereka dianggap asam resisten negatif (AAR-).
Referensi
- Apurba, s. & Sandhya, b. (2016). Essentials of Practical Microbiology (Edisi pertama.). Penerbit Medis Jaypee Brothers.
- Bauman, r. (2014). Mikrobiologi dengan deseodas berdasarkan sistem tubuh (edisi ke -4.). Pearson Education, Inc.
- Heritage, J., Evans, e. & Killington, a. (seribu sembilan ratus sembilan puluh enam). Mikrobiologi pengantar (Edisi pertama.). Cambridge University Press.
- Morello, J., Granato, hlm. Wilson, m. & Morton, v. (2006). Manual Laboratorium dan Buku Kerja dalam Mikrobiologi: Aplikasi untuk Perawatan Pasien (Edisi ke -11.). Pendidikan McGraw-Hill.
- Vasanthakumari, r. (2007). Buku Teks Mikrobiologi (Edisi pertama.). B.yo. Publikasi Pvt.

