Atom karbon
- 699
- 145
- Frederick Pfeffer
Kami menjelaskan apa itu atom karbon, struktur elektronik, karakteristik, dan hibridisasi orbital.
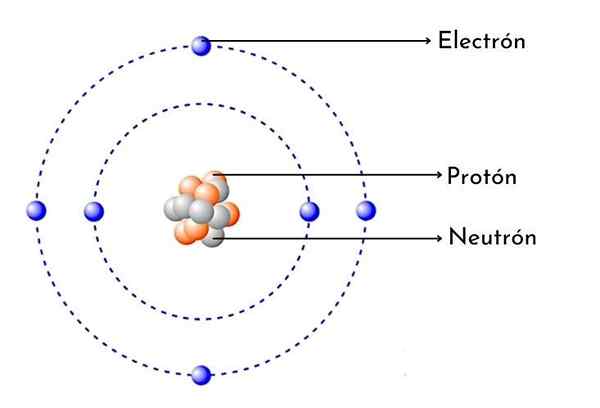
 Skema Atom Karbon
Skema Atom Karbon Apa itu Atom Karbon?
Karbon adalah elemen nomor 6 dari tabel periodik dan merupakan salah satu elemen terpenting yang ada. Kepentingannya muncul dari kimia yang sangat kaya dan beragam yang membuat elemen ini membentuk Basis Kehidupan di Planet Bumi, seperti yang kita tahu.
Ini tentang a bukan metal milik Kelompok 14 dari tabel periodik (sebelumnya Grup 4a) dan periode kedua. Dalam bentuk alami, ia dikaitkan dengan batubara (baik mineral dan sayuran) dan jelaga, di mana ia terutama dalam bentuk grafit atau alotrop lainnya.
Dia Atom karbon Itu adalah salah satu yang terkecil dari tabel periodik. Itu adalah atom tetravalen, yaitu, dapat terbentuk hingga empat tautan dengan atom lain yang sama atau berbeda dari yang sama.
Karbon sangat penting bagi manusia. Ini adalah salah satu komponen utama tubuh kita, membentuk lebih dari 19% dari massanya. Selain itu, ia juga memiliki beberapa aplikasi teknologi yang berasal dari sifat atomnya.
Karakteristik atom karbon
- Atom karbon adalah non -logam: Karbon adalah elemen non -metalik yang dapat dikombinasikan dengan banyak elemen lain dari tabel periodik. Atom karbon dapat memperoleh atau memberikan elektron ke atom lain, masing -masing menjadi anion atau kation.
- Ia memiliki 6 proton di dalam nukleusnya: Jumlah atom karbon adalah 6, yang berarti memiliki 6 proton dalam nukleusnya. Ini juga berarti bahwa atom karbon netral memiliki 6 elektron di sekitar nukleus.
Dapat melayani Anda: pemisahan magnetik- Itu milik blok p dari tabel periodik: Konfigurasi karbon elektronik dalam keadaan fundamentalnya adalah 1s2 2s2 2 p2. Seperti dapat dilihat, elektron Valencia terakhir terletak di orbital P, sehingga karbon milik blok P dari tabel periodik.
- Valensi atom karbon adalah +2, +4 dan -4: Lapisan valensi karbon hanya hilang 4 elektron untuk diisi sepenuhnya dan dengan demikian memperoleh konfigurasi elektronik gas neon mulia. Untuk alasan ini, karbon dapat membentuk anion karbida, c4-, yang memiliki 4 elektron lebih dari karbon netral. Di sisi lain, atom karbon juga dapat kehilangan dua elektron 2p, sehingga menjadi kation karbon (c2+), atau semua 4 elektron di Valencia, menjadi kation karbonik (c4+).
- Anda dapat membentuk banyak dari banyak: Karbon dasar dapat ditemukan dalam dua bentuk alami umum yang bersifat grafit dan berlian, yang memiliki sifat yang berlawanan secara radikal. Selain itu, Anda dapat membentuk orang yang berbeda, karbon dan nanotube graphene.
Tiga isotop atom karbon
Semua atom karbon memiliki enam proton dalam nukleus mereka, tetapi tidak semua memiliki jumlah neutron yang sama, sehingga menimbulkan tiga isotop:
- Karbon-12 (12C): Ini adalah yang paling stabil dan berlimpah (sekitar 98,9%). Ia memiliki 6 neutron di dalam nukleusnya.
- Karbon-13 (13C): Memiliki 7 neutron.
- Karbon-14 (14C): Ini adalah radioaktif yang digunakan untuk tanggal objek lama.
Struktur elektronik atom karbon
Seperti setiap atom karbon, ia memiliki enam proton positif dalam nukleusnya, maka ia juga memiliki 6 elektron dengan beban negatif berbalik.
Dapat melayani Anda: alikuot (kimia)Cara elektron ini didistribusikan atau konfigurasi elektronik atom karbon adalah:
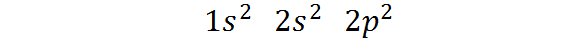
Konfigurasi elektronik ini menunjukkan itu Karbon memiliki 2 elektron dalam orbital 1S, Dua elektron dalam orbital 2s, Dan dua elektron didistribusikan di antara tiga orbital 2p.
Di sisi lain, lapisan valensi untuk karbon adalah lapisan L, yang sesuai dengan level n = 2, karena itu adalah lapisan level tertinggi yang mengandung elektron. Seperti yang dapat kita lihat, karbon secara total 4 elektron di level 2, Jadi kami mengatakan itu Ini memiliki 4 elektron valencia.
Inilah alasan mengapa karbon berada di mana ia sebelumnya disebut kelompok 4A dari tabel periodik.
Hibridisasi orbital atom dalam atom karbon
Atom bereaksi dan terhubung satu sama lain melalui elektron valensi mereka dan orbital yang mereka tempati. Namun, yang terakhir tidak selalu memiliki orientasi yang memadai untuk membentuk tautan yang diperlukan.
Teori Tautan Valencia menyatakan bahwa atom mencampur orbital atomnya untuk membentuk orbital hibrida baru yang memang memiliki panduan yang tepat. Proses ini disebut hibridisasi.
Bergantung pada jumlah atom yang dikaitkan dengan atom karbon, ia akan mencampur atau menghibur sejumlah orbital atom murni yang berbeda. Ini memunculkan Tiga hibridisasi yang berbeda, Apakah mereka:
Sp
Terjadi ketika karbon hanya dikaitkan dengan Dua atom. Dalam hal ini, orbital S dengan salah satu dari tiga orbital P dicampur, menimbulkan dua orbital sp yang menunjuk ke arah yang berlawanan (180º dari satu sama lain).
Dapat melayani Anda: Barometer MerkuriusDua orbital P yang dibiarkan tanpa pencampuran digunakan untuk membentuk ikatan PI. Atom karbon dapat terbentuk Link triple (yang berisi dua ikatan PI) dengan satu atom, atau dapat terbentuk Dua tautan ganda, satu dengan masing -masing atom (dan dengan tautan masing -masing PI).
Sp2
Saat karbon ingin bergabung Tiga atom, Anda membutuhkan tiga orbital hibrida, jadi campur tiga orbital murni: orbital S dan dua orbital p. Ini menghasilkan tiga orbital hibrida SP2 yang menunjuk ke sudut -sudut segitiga sama sisi.
Orbital P yang tidak digunakan, dapat membentuk tautan PI dengan salah satu dari tiga atom yang terhubung, sehingga menimbulkan ikatan rangkap.
Sp3
Saat karbon akan terhubung ke Empat atom, Campurkan 4 orbital murni dari lapisan valensi Anda untuk menghasilkan 4 orbital hibrida SP3. Ini menunjuk ke simpul tetrahedron biasa.
Karena tidak ada orbital untuk membentuk ikatan PI, karbon dengan hibridisasi SP3 Anda hanya dapat membentuk empat tautan sederhana dan tidak ada banyak tautan.
Referensi
- Britannica, editor Encyclopaedia. Karbon - Fakta, Penggunaan, & Properti. Diambil dari https: // www.Britannica.com/sains/karbon-kimia-elemen
- Laboratorium Pemantauan Global. (S. F.). Gas rumah kaca siklus karbon. Diambil dari https: // gml.NOAA.GOV/CCG/Isotop/Kimia.Html

