Karakteristik Treonin, Fungsi, Degradasi, Manfaat
- 1404
- 188
- Frederick Pfeffer
Itu Treonina (THR, T) atau TREO-α-amino-β-Butyric Acid adalah salah satu asam amino konstituen dari protein sel. Karena manusia dan hewan vertebrata lainnya tidak memiliki rute biosintesis untuk produksinya, Treonine dianggap sebagai salah satu dari 9 asam amino esensial yang harus diperoleh dengan diet.
Treonine adalah yang terakhir dari 20 asam amino umum yang ditemukan dalam protein, sebuah fakta yang terjadi dalam sejarah lebih dari seabad setelah penemuan asparagin (1806), yang merupakan asam amino pertama yang dijelaskan.
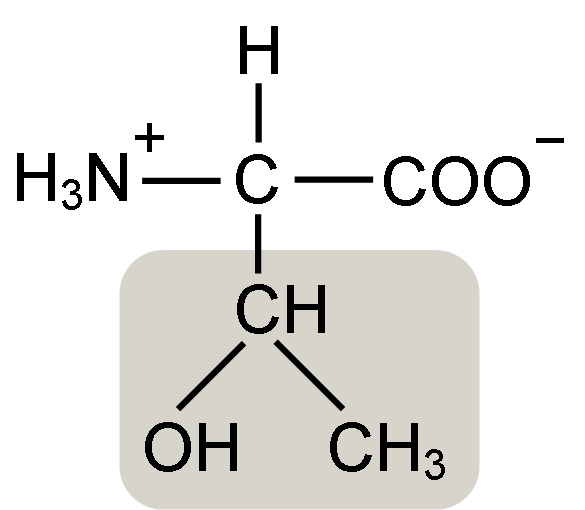
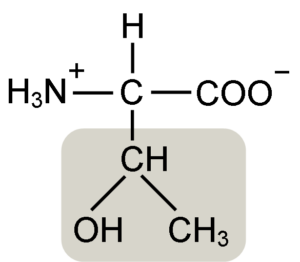 Struktur Asam Amino Treonine (Sumber: Keycin [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons)
Struktur Asam Amino Treonine (Sumber: Keycin [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons) Ditemukan oleh William Cumming Rose pada tahun 1936, yang menciptakan istilah "treonine" untuk kesamaan struktural yang ia temukan antara asam amino ini dan asam haraonat, senyawa yang berasal dari gula treose.
As amino acid protein, treonine has multiple functions in the cells, among which the binding site for carbohydrate chains typical of glycoproteins and the recognition site for protein kinases with specific functions (treonine proteins/serine kinases) stand out).
Demikian pula, treonin adalah komponen penting dari protein seperti enamel gigi, elastin dan kolagen dan juga memiliki fungsi penting dalam sistem saraf. Ini digunakan sebagai suplemen makanan dan sebagai "mitigator" dari keadaan fisiologis kecemasan dan depresi.
[TOC]
Karakteristik
Treonin milik kelompok asam amino kutub yang memiliki kelompok r atau rantai samping yang kekurangan beban positif atau negatif (asam amino polar yang tidak dimuat).
Karakteristik kelompok R -nya dibuat oleh asam amino yang sangat larut (hidrofilik atau hidrofilik), yang juga berlaku untuk anggota lain dari kelompok ini, seperti sistein, serin, asparagin dan glutamin.
Bersama dengan tryptophan, fenilalanin, isoleusin dan tirosin, treonin adalah salah satu dari lima asam amino yang memiliki fungsi glukogenik dan ketogenik, karena dari metabolismenya ada perantara yang relevan seperti piruvat dan succinyl-COA.
Asam amino ini memiliki perkiraan berat molekul 119 g/mol; Seperti banyak asam amino tanpa beban, ia memiliki titik isoelektrik sekitar 5.87 dan frekuensinya dalam struktur protein mendekati 6%.
Beberapa penulis mengelompokkan treonine bersama dengan asam amino lainnya dari rasa "manis", di antaranya, misalnya, serin, glisin dan alanine adalah.
Struktur
Asam α-amino seperti treonine memiliki struktur umum, yaitu itu umum untuk semua. Ini dibedakan dengan adanya atom karbon yang dikenal sebagai "karbon α", yang merupakan kiral dan di mana empat jenis molekul atau substituen berbeda bergabung.
Karbon ini berbagi salah satu ikatannya dengan atom hidrogen, yang lain dengan kelompok R, yang merupakan karakteristik untuk setiap asam amino, dan dua lainnya ditempati oleh gugus amino (NH2) dan karboksil (COOH), yang umum untuk semua Asam amino.
Kelompok Tonine R memiliki gugus hidroksil yang memungkinkannya membentuk jembatan hidrogen dengan molekul lain dalam media berair. Identitasnya dapat didefinisikan sebagai kelompok alkoholik (etanol, dengan dua atom karbon), yang telah kehilangan salah satu hidrogennya untuk bergabung dengan atom karbon α (-chah-ch3).
Grup ini -OH dapat berfungsi sebagai "jembatan" atau situs serikat untuk berbagai molekul (ini dapat digabungkan, misalnya, rantai oligosakarida selama pembentukan glikoprotein) sehingga merupakan salah satu dari mereka yang bertanggung jawab atas pembentukan pembentukan pembentukan dari turunan treonin yang dimodifikasi.
Bentuk aktif secara biologis dari asam amino ini adalah L-treonin dan inilah yang berpartisipasi baik dalam pembentukan struktur protein dan dalam berbagai proses metabolisme di mana ia bertindak.
Fungsi
Sebagai protein asam amino, treonin adalah bagian dari struktur banyak protein di alam, di mana kepentingan dan kekayaannya tergantung pada identitas dan fungsi protein yang menjadi miliknya.
Dapat melayani Anda: heterosis: peningkatan hewan, pada tanaman, manusiaSelain fungsi strukturalnya dalam pembentukan urutan peptida protein, Treonine memenuhi fungsi lain baik dalam sistem saraf dan di hati, di mana ia berpartisipasi dalam metabolisme lemak dan mencegah akumulasi dalam organ ini di organ ini.
Treonine adalah bagian dari urutan yang diakui oleh enzim serín/treonina kinase, yang bertanggung jawab untuk berbagai proses fosforilasi protein, penting untuk regulasi multiplisitas fungsi dan peristiwa pensinyalan intraseluler.
Ini juga digunakan untuk pengobatan beberapa gangguan usus dan pencernaan dan kegunaannya dalam pelemahan kondisi patologis seperti kecemasan dan depresi telah ditunjukkan.
L-treonin, juga, adalah salah satu asam amino yang diperlukan untuk mempertahankan keadaan pluripoten sel induk embrionik tikus, sebuah fakta yang tampaknya terkait dengan metabolisme S-adenosyl-metionin dan dengan peristiwa metilasi histones, yang secara langsung bersifat langsung terlibat dalam ekspresi gen.
Di industri
Properti umum untuk banyak asam amino adalah kemampuannya untuk bereaksi dengan kelompok kimia lain seperti aldehida atau keton untuk pembentukan "rasa" karakteristik dari banyak senyawa.
Di antara asam amino ini adalah treonin, yang sebagai serin, bereaksi dengan sukrosa selama TOS.
Treonine hadir dalam banyak obat yang berasal dari alam dan juga dalam banyak formulasi suplemen gizi yang diresepkan untuk pasien dengan kekurangan gizi atau yang memiliki diet buruk pada asam amino ini.
Fungsi L-treonine lainnya yang paling terkenal, dan itu telah tumbuh dari waktu ke waktu, adalah aditif dalam persiapan makanan terkonsentrasi untuk industri produksi babi dan unggas.
L-treonine digunakan dalam industri ini sebagai suplemen makanan dalam formulasi yang buruk dari sudut pandang protein, karena ini memberikan keunggulan ekonomi dan mengurangi kekurangan protein kasar yang dikonsumsi hewan ternak ini.
Bentuk utama produksi asam amino ini biasanya dengan fermentasi mikroba dan angka produksi dunia untuk tujuan pertanian untuk tahun 2009 melebihi 75 ton.
Biosintesis
Treeonine adalah salah satu dari sembilan asam amino esensial untuk manusia, yang berarti bahwa ia tidak dapat disintesis oleh sel -sel tubuh dan, oleh karena itu, yang harus diperoleh dari protein hewan atau tanaman yang dipasok dengan diet harian sehari -hari.
Tumbuhan, jamur, dan bakteri mensintesis treonin dari rute serupa yang dapat menghadirkan beberapa perbedaan satu sama lain. Namun, sebagian besar organisme ini mulai dari Asparto sebagai prekursor, tidak hanya untuk Treonine, tetapi juga untuk Methodin dan Lysine.
Rute biosintetik dalam mikroba
Rute biosintesis L-treonin dalam mikroorganisme seperti bakteri terdiri dari lima langkah yang dikatalisis oleh enzim yang berbeda. Substrat keberangkatan, seperti yang dikomentari, adalah aspartat, yang difosforilasi oleh quinasa yang bergantung pada enzim ATP aspartat.
Reaksi ini menghasilkan metabolit l-asphat fosfat (L-aspartil-p) yang berfungsi sebagai substrat untuk enzim aspartil aspartil semiadehidik dehidrogenase, yang mengkatalisasi konversi menjadi aspartil semi-bergantung semi-bergantung semi-teori semi semi-bergantung semi semi semi-te-te-the.
Aspartil semiiardhaide dapat digunakan baik untuk biosintesis L-lisin dan untuk biosintesis l-treonin; Dalam hal ini, molekul ini digunakan oleh enzim homoserin yang bergantung pada NADPH yang bergantung pada produksi L-homoserina.
L-homoserin difosforilasi menjadi L-homoserin fosfat (L-homoserina-P) oleh kinase yang bergantung pada ATP homoserin dan produk reaksi tersebut, pada gilirannya, adalah substrat dari enzim sintase treonin, yang mampu mensintesis L-Trinina.
L-metionin dapat disintesis dari L-homoserin yang diproduksi pada langkah sebelumnya, sehingga merupakan rute "kompetitif" untuk sintesis L-treonin.
L-treonin yang disintesis dengan cara ini dapat digunakan untuk sintesis protein atau juga dapat digunakan di hilir untuk sintesis glisin dan L-leusin, dua asam amino yang relevan juga dari sudut pandang protein.
Dapat melayani Anda: teori evolusionerPeraturan
Penting untuk menyoroti bahwa tiga dari lima enzim yang berpartisipasi dalam biosintesis L-treonin pada bakteri diatur oleh produk reaksi dengan umpan balik negatif. Ini adalah kinase aspartate, homoserine dehydrogenase dan homoserine kinase.
Selain itu, regulasi rute biosintetik ini juga tergantung pada persyaratan seluler produk biosintetik lainnya yang terkait dengannya, karena pembentukan L-lisin, L-metionin, L-isoleusin dan glisin tergantung pada rute produksi produksi produksi dari L-treonine.
Degradasi
Treonine dapat terdegradasi oleh dua rute yang berbeda untuk menghasilkan piruvat atau suksinil-CoA. Yang terakhir adalah produk terpenting dari katabolisme treonin pada manusia.
Metabolisme treonin terjadi terutama di hati, tetapi pankreas, meskipun pada tingkat yang lebih rendah, juga berpartisipasi dalam proses ini. Rute ini dimulai dengan pengangkutan asam amino melalui membran plasma hepatosit melalui transporter tertentu.
Produksi piruvat dari treonine
Konversi treonine menjadi piruvat terjadi berkat transformasi menjadi glisin, yang terjadi dalam dua langkah katalitik yang dimulai dengan pembentukan 2-amino-3-ecotobutirate dari treonin dan dengan aksi enzim treonin dehidrogenase.
Pada manusia, rute ini hanya mewakili antara 10 dan 30% dari katabolisme treonin, bagaimanapun, kepentingannya relatif terhadap organisme yang dipertimbangkan karena, pada mamalia lain, misalnya, ini jauh lebih relevan berbicara secara katabolik yang lebih relevan.
Produksi Succinil-CoA dari Treonina
Seperti halnya metionin, valina dan isoleusin, atom karbon treonin juga digunakan untuk produksi succunil-CoA. Proses ini dimulai dengan konversi asam amino menjadi α-methobutirate, yang kemudian digunakan sebagai substrat dari enzim dehidrogenase α-zo-stoat untuk melakukan propionil-CoA.
Transformasi treonin menjadi α-methobutirate dikatalisis oleh enzim dehidratase, yang menyiratkan hilangnya molekul air (H2O) dan ion amonium lainnya (NH4+).
Propionyl-CoA dikarboksilasi dalam methylmalonyl-CoA melalui reaksi dua langkah yang membutuhkan masuknya atom karbon bikarbonat (HCO3-). Produk ini berfungsi sebagai substrat untuk dependen Methylmalonil-CoA mutasa-coenzyme B12, yang "mengencingi" molekul untuk menghasilkan suksinil-koa.
Produk katabolik lainnya
Selain itu, kerangka karbon treonin dapat digunakan secara katabolik untuk produksi asetil-CoA, yang juga memiliki implikasi penting dari sudut pandang energi dalam sel tubuh.
Dalam organisme tertentu, Treonine juga berfungsi sebagai substrat dari beberapa rute biosintesis seperti isoleucine, misalnya. Dalam hal ini, melalui 5 langkah katalitik, α-ekthobutirate yang berasal dari katabolisme treonin dapat diarahkan pada pembentukan isoleusin.
Makanan Kaya Treonine
Meskipun sebagian besar makanan berlimpah dalam protein memiliki persentase tertentu dari semua asam amino, telah ditentukan bahwa telur, susu, kedelai dan gelatin sangat kaya akan asam amino treonin.
Treonine juga ada di daging hewani seperti ayam, babi, kelinci, domba dan berbagai jenis burung. Dalam makanan asal tanaman itu berlimpah di bidang choles, pada bawang, bawang putih, chard dan terong.
Itu juga ditemukan dalam nasi, jagung, dedak gandum, biji -bijian legum dan dalam banyak buah seperti stroberi, pisang, anggur, nanas, plum dan kacang -kacangan lainnya yang kaya protein seperti kacang atau pistachio, antara lain.
Manfaat Asupan Anda
Menurut Komite Pakar Organisasi Kesehatan Dunia untuk Pertanian dan Makanan (WHO, FAO), persyaratan harian Treonina untuk manusia dewasa rata -rata adalah sekitar 7 mg per kilogram berat badan, yang harus diperoleh dari makanan yang dicerna dengan diet dengan diet.
Dapat melayani Anda: merah fenol: karakteristik, persiapan, aplikasiAngka -angka ini berasal dari data eksperimental yang diperoleh dari penelitian yang dilakukan dengan pria dan wanita, di mana jumlah treonin ini cukup untuk mendapatkan keseimbangan nitrogen positif dalam sel tubuh.
Namun, penelitian dengan anak-anak berusia antara 6 bulan dan satu tahun telah menunjukkan bahwa untuk ini persyaratan minimum L-treonin adalah antara 50 dan 60 mg per kilogram berat per hari.
Di antara manfaat utama dari asupan suplemen nutrisi atau obat-obatan dengan formulasi khusus yang kaya akan L-treonine adalah pengobatan sklerosis amyotrophic lateral atau penyakit Lou Gehrig.
Pasokan treonine tambahan mendukung penyerapan nutrisi di usus dan juga berkontribusi pada peningkatan fungsi hati. Ini juga penting untuk pengangkutan gugus fosfat melalui sel.
Gangguan Kekurangan
Pada anak kecil ada cacat terlahir dalam metabolisme treonin yang menyebabkan penundaan pertumbuhan dan gangguan metabolik terkait lainnya.
Kekurangan dalam asam amino ini telah dikaitkan dengan beberapa kegagalan kenaikan berat badan anak, selain patologi lain yang terkait dengan kurangnya retensi nitrogen dan kehilangan urin.
Manusia yang mengalami diet yang buruk di Treonina dapat memiliki kecenderungan yang lebih besar untuk menderita hati berlemak dan beberapa infeksi usus yang terkait dengan asam amino ini.
Referensi
- Barret, g., & Elmore, D. (2004). Asam dan peptida amino. Cambridge: Cambridge University Press.
- Borgonha, s., Regan, m. M., Oh s. H., Condon, m., & Muda, v. R. (2002). Persyaratan treonin orang dewasa yang sehat, ditampilkan dengan indikator 24 jam teknik keseimbangan asam aminino. American Journal of Clinical Nutrition, 75(4), 698-704.
- Bradford, h. (1931). Sejarah penemuan asam amino. Ii. Ulasan asam amino yang dijelaskan sejak 1931 sebagai komponen protein asli. Kemajuan dalam Kimia Protein, 81-171.
- Champe, hlm., & Harvey, R. (2003). Asam amino asam amino. Di dalam Ulasan Ilustrasi Lippincott: Biokimia (Edisi ke -3., pp. 1-12). Lippincott.
- De Lange, C. F. M., Gillis, a. M., & Simpson, G. J. (2001). Pengaruh asupan treonin pada deposisi protein-tubuh whoe dan usation threonine pada babi yang menanam yang diberi makan diet murni. Jurnal Ilmu Hewan, 79, 3087-3095.
- Edelman, a., Blumenthal, d., & Krebs, dan. (1987). Protein serin/treonin kinase. Annu. Putaran., 56, 567-613.
- Edsall, J. (1960). Asam aminino, protein dan biokimia kanker (Vol. 241). London: Academic Press, Inc.
- Rumah, j. D., Hall, b. N., & Brosnan, J. T. (2001). Metabolisme treonin dalam hepatosit tikus yang terisolasi. American Journal of Physiology - Endokrinologi dan Metabolisme, 281, 1300-1307.
- HUDSON, b. (1992). Biokimia protein makanan. Springer-science+media bisnis, b.V.
- Kaplan, m., & Flavin, m. (1965). Biosintesis Threonine. Di jalur dalam jamur dan bakteri dan mekanisme reaksi isomerisasi. Jurnal Kimia Biologis, 240(10), 3928-3933.
- Kidd, m., & Kerr, b. (seribu sembilan ratus sembilan puluh enam). L-threonine for unggas: ulasan. Applied Poultry Science, Inc., 358-367.
- Pratt, e., Snyderman, s., Cheung, m., Norton, hlm., & Holt, dan. (1954). Persyaratan treonin bayi normal. Jurnal Nutrisi, 10(56), 231-251.
- Rigo, J., & Senterre, J. (1980). Asupan treonin yang optimal untuk infating prematur memberi makan nutrisi oral atau parenteral. Jurnal Nutrisi Parenteral dan Enteral, 4(1), 15-17.
- Shyh-chang, n., Locasale, J. W., Lysssiotis, c. KE., Zheng, dan., Teo, r. DAN., Ratanasirintrawoot, s.,... Cantley, l. C. (2013). Pengaruh metabolisme treonin pada S-adenensylmethionine dan metilasi histone. Sains, 339, 222-226.
- Vickery, h. B., & Schmidt, c. L. KE. (1931). Sejarah penemuan asam amino. Ulasan Kimia, 9(2), 169-318.
- Web MD. (N.D.). Diperoleh 10 September 2019, dari www.Webmd.com/vitamin/ai/bahan MMono-1083/treonine
- Wormser, e. H., & Pardee, untuk. B. (1958). Regulasi biosintesis treonin di Escherichia coli. Arsip Biokimia dan Biofisika, 78(2), 416-432.
- XUNYAN, x., Quinn, hlm., & Xiaoyuan, x. (2012). Gerbang Penelitian. Diperoleh 10 September 2019, dari www.ResearchGate.net/figure/the-biosintesis-pathway-of-l-threonine-the-pathway-consists-of-fi-ve-enzymmatic-steps_fig1_232320671

