Sejarah Tungsten, Properti, Struktur, Penggunaan

- 1498
- 269
- Pete Lesch
Dia tungsten, Wolframio atau Volframium adalah logam transisi berat yang simbol kimianya w. Terletak pada periode 6 dengan kelompok 6 dari tabel periodik, dan jumlah atomnya adalah 74. Namanya memiliki dua makna etimologis: batu keras dan busa serigala; Yang kedua adalah karena logam ini juga dikenal sebagai Wolframio.
Ini adalah logam abu -abu perak dan, bahkan jika rapuh, memiliki kekerasan, kepadatan, dan titik fusi yang tinggi dan titik didih dan titik didih. Oleh karena itu, telah digunakan dalam semua aplikasi yang melibatkan suhu tinggi, tekanan atau kekuatan mekanik, seperti bor, proyektil, atau filamen pemancaran radiasi.
 Tungsten Bar dengan permukaan teroksidasi sebagian. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]
Tungsten Bar dengan permukaan teroksidasi sebagian. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] Penggunaan paling terkenal untuk logam ini, pada tingkat budaya dan populer, adalah dalam filamen umbi listrik. Yang telah memanipulasi mereka akan menyadari betapa rapuhnya mereka; Namun, mereka tidak terbuat dari tungsten murni, yang lunak dan ulet. Selain itu, dalam matriks logam seperti paduan, ini memberikan ketahanan dan kekerasan yang sangat baik.
Ini dikarakterisasi dan dibedakan dengan menjadi logam dengan titik fusi tertinggi, dan karena juga lebih padat daripada timbal yang sama, dilampaui hanya oleh logam lain seperti osmium dan iridium. Ini juga merupakan logam terberat yang dikenal untuk memenuhi peran biologis dalam tubuh.
Di sebagian besar senyawa ioniknya, anion tungstate berpartisipasi, wo42-, yang dapat polimerisasi untuk menyebabkan cluster dalam media asam. Di sisi lain, tungsten dapat membentuk senyawa intermetalik, atau sterisasi dengan logam atau garam anorganik sehingga padatan mereka memperoleh berbagai bentuk atau konsistensi.
Ini tidak terlalu berlimpah di korteks bumi, memiliki satu ton hanya 1,5 gram logam ini. Selain itu, karena merupakan elemen berat, asalnya adalah intergalaksi; Khususnya ledakan supernova, yang harus melemparkan "jet" atom tungsten ke planet kita selama pembentukannya.
[TOC]
Sejarah
Etimologi
Sejarah tungsten atau wolframio memiliki dua wajah serta nama mereka: satu swiss, dan orang Jerman lainnya. Pada 1600 -an, di daerah yang saat ini ditempati oleh Jerman dan Austria, para penambang mengerjakan ekstraksi tembaga dan timah untuk menghasilkan perunggu.
Pada saat itu para penambang bertemu duri dalam proses: ada mineral yang sangat sulit; mineral terdiri dari wolframite, (iman, mn, mg) wo4, yang mempertahankan atau "melahap" timah seolah -olah itu adalah serigala.
Oleh karena itu etimologi untuk unsur ini, 'serigala' serigala dalam bahasa Spanyol, serigala yang makan timah; dan 'ram' busa atau krim, yang kristalnya menyerupai bulu hitam panjang. Itu agar nama 'wolfram' atau 'wolframio' muncul untuk menghormati pengamatan pertama ini.
Pada 1758, di sisi Swiss dengan mineral serupa, Scheelita, Cawo4, Dia dinamai 'Tung Sten', yang berarti 'batu keras'.
Kedua nama, Wolframio dan Tungsten, banyak digunakan secara bergantian, hanya tergantung pada budaya. Di Spanyol, misalnya, dan di Barat Eropa, logam ini lebih dikenal oleh Wolframio; Sementara di benua Amerika, nama tungsten mendominasi.
Pengakuan dan penemuan
Kemudian diketahui bahwa antara abad ketujuh belas dan kedelapan belas ada dua mineral: wolframite dan scheelita. Tetapi siapa yang melihat bahwa ada logam yang berbeda dari yang lain? Mereka hanya bisa dicirikan sebagai mineral, dan pada tahun 1779 ahli kimia Irlandia Peter Woulfe dengan hati -hati menganalisis wolframite dan menyimpulkan keberadaan Wolframium.
Itu dapat melayani Anda: asam perbromic (HBRO4): sifat, risiko dan penggunaanDi sisi Swiss, sekali lagi, Carl Wilhelm Scheele pada 1781 mampu mengisolasi tungsten sebagai wo3; Dan bahkan lebih lagi, ia memperoleh asam tumatik (atau wolphramic), h2Wo4 dan senyawa lainnya.
Namun, ini tidak cukup untuk mencapai logam murni, karena perlu mengurangi asam ini; yaitu, tunduk pada proses seperti itu yang tidak dapat oksigen dan mengkristal sebagai logam. Carl Wilhelm Scheele tidak memiliki metodologi yang tepat untuk reaksi reduksi kimia ini.
Di sinilah saudara -saudara Spanyol D'Aluyar, Fausto dan Juan José, yang mengurangi kedua mineral (Wolframite dan Scheelita) dengan batubara, di kota Bergara, di kota Bergara. Dua diberikan jasa dan kehormatan menjadi penemu wolframium atau tungsten logam (w).
Baja dan umbi
 Bohlam apa pun dengan filamen tungsten. Sumber: Pxhere.
Bohlam apa pun dengan filamen tungsten. Sumber: Pxhere. Seperti logam lainnya, penggunaannya menentukan sejarahnya. Di antara yang paling menonjol pada akhir abad ke-19, adalah paduan baja tungsten, dan filamen tungsten untuk menggantikan karbon di dalam umbi listrik. Dapat dikatakan bahwa umbi pertama, seperti yang kita ketahui, dipasarkan pada tahun 1903-1904.
Properti
Penampilan fisik
Itu adalah logam abu -abu perak dan berkilau. Rapuh tapi kekerasan besar (tidak membingungkan dengan keuletan). Jika potongannya bermurni tinggi menjadi lunak dan keras, baik atau lebih dan beberapa baja.
Nomor atom
74.
Masa molar
183.85 g/mol.
Titik lebur
3422ºC.
Titik didih
5930ºC.
Kepadatan
19.3 g/ml.
Panas fusi
52.31 kJ/mol.
Panas penguapan
774 kJ/mol.
Kapasitas panas molar
24.27 kJ/mol.
Kekerasan moh
7.5.
Elektronegativitas
2,36 pada skala Pauling.
Radio atom
139 PM
Resistivitas listrik
52.8 nΩ · m pada 20ºC.
Isotop
Ini menyajikan terutama di alam sebagai lima isotop: 182W, 183W, 184W, 186W dan 180W. Menurut massa molar 183 g/mol, yang rata -rata massa atom isotop ini (dan tiga puluh radioisotop lainnya), masing -masing atom tungsten atau wolframium memiliki sekitar seratus sepuluh neutron (74 + 110 = 184).
Kimia
Ini adalah sangat tahan terhadap logam korosi, seperti lapisan tipis wo3 melindunginya terhadap serangan oksigen, asam dan alkali. Setelah dibubarkan dan diendapkan dengan reagen lain, garamnya diperoleh, yang disebut wolframatat atau tungstat; Di dalamnya tungsten memiliki keadaan oksidasi +6 (dengan asumsi ada kation w6+).
Pengelompokan asam
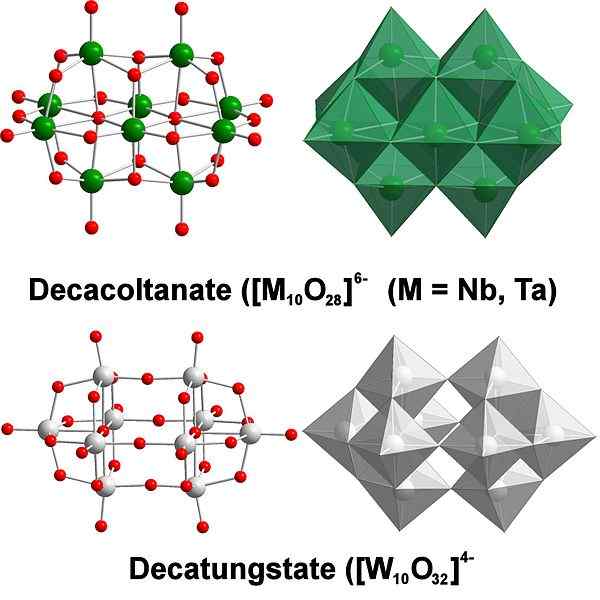 Decatungstate, contoh polyaxomethalate tungsten. Sumber: Scifanz [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Decatungstate, contoh polyaxomethalate tungsten. Sumber: Scifanz [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Secara kimia tungsten cukup khusus karena ionnya cenderung dikelompokkan (pengelompokan dalam bahasa Inggris) untuk membentuk heteropolisid atau poliAxomethalate. Apakah mereka? Mereka adalah kelompok atau kelompok atom yang berikatan untuk mendefinisikan tubuh tiga dimensi; terutama, satu dengan struktur kandang bola, di mana mereka "melampirkan" atom lain.
Semuanya dimulai dari tungstate anion, wo42-, Yang dalam medium asam diproton (hwo4-) dan terhubung dengan anion tetangga untuk membentuk [w2SALAH SATU7(OH)2]2-; Dan ini pada gilirannya bergabung dengan [w lain2SALAH SATU7(OH)2]2- Untuk berasal [w4SALAH SATU12(OH)4]4-. Demikianlah sampai dalam larutan ada beberapa politungstat.
Dapat melayani Anda: lithium chloride (LICL): properti, risiko dan penggunaanParathungstate a dan b, [w7SALAH SATU24]6- dan H2W12SALAH SATU4210-, masing -masing, mereka adalah salah satu yang paling menonjol dari poliad ini.
Ini bisa menjadi tantangan untuk mempertimbangkan sketsa dan struktur Lewis; Tetapi pada prinsipnya cukup untuk memvisualisasikannya sebagai set wo octahedra6 (gambar atas).
Perhatikan bahwa Octahedra keabu -abuan ini akhirnya mendefinisikan Decatungstate, seorang Politungstate; Jika heteroátomo mengunci di dalamnya (misalnya, fosfor), itu akan menjadi polyaxomethalate.
Struktur dan konfigurasi elektronik
Fase kristal
Atom tungsten menentukan struktur kubik yang berpusat dengan tubuh (bcc, oleh Kubik yang Ditdaftar Tubuh). Bentuk kristal ini dikenal sebagai fase α; Sedangkan fase β juga kubik, tetapi sedikit padat. Baik fase atau bentuk kristal, α dan β, dapat hidup berdampingan dalam keseimbangan dalam kondisi normal.
Butir kristal dari fase α adalah isometrik, sedangkan yang dari fase β menyerupai kolom. Terlepas dari bagaimana gelasnya, dalam pemerintahan ini. Kalau tidak, titik -titik leleh dan mendidih yang tinggi tidak dapat dijelaskan, atau kekerasan dan kepadatan tinggi tungsten.
Tautan logam
Atom tungsten entah bagaimana harus sangat bersatu. Untuk meningkatkan dugaan, konfigurasi elektronik logam ini harus diamati sebelumnya:
[Xe] 4f145 d46s2
Orbital 5D sangat besar dan kabur, yang akan menyiratkan bahwa antara dua atom dekat dengan ada tumpang tindih orbital yang efektif. Juga, orbital 6s berkontribusi pada pita yang dihasilkan, tetapi pada tingkat yang lebih rendah. Sedangkan orbital 4F memiliki "sangat dalam" dan kontribusinya karena itu pada tautan logam lebih rendah.
Ini, ukuran atom, dan butiran kristal, adalah variabel yang menentukan kekerasan tungsten dan kepadatannya.
Keadaan oksidasi
Dalam tungsten atau logam wolframium atom W memiliki keadaan oksidasi nol (w0). Kembali ke konfigurasi elektronik, orbital 5d dan 6s dapat "mengosongkan" elektron tergantung jika W berada di perusahaan atom yang sangat elektronegatif, seperti oksigen atau fluorin.
Ketika dua elektron 6S hilang, tungsten memiliki keadaan oksidasi +2 (w2+), Apa yang menghasilkan kontrak atom itu.
Jika Anda juga kehilangan semua elektron orbital 5D Anda, status oksidasi Anda akan menjadi +6 (w6+); Dari sini tidak bisa menjadi lebih positif (secara teori), karena orbital 4F untuk menjadi internal akan membutuhkan energi yang besar untuk menghilangkan elektron mereka. Artinya keadaan oksidasi paling positif adalah +6, di mana tungsten belum kecil.
Tungsten (VI) ini sangat stabil dalam kondisi asam atau dalam banyak senyawa teroksigenasi atau terhalogenasi. Keadaan oksidasi positif dan mungkin lainnya adalah: +1, +2, +3, +4, +5 dan +6.
Tungsten juga bisa mendapatkan elektron jika dikombinasikan dengan lebih sedikit atom elektronegatif darinya. Dalam hal ini, atom mereka menjadi lebih besar. Itu bisa mendapatkan maksimal empat elektron; yaitu, memiliki keadaan oksidasi -4 (w4-).
Memperoleh
Sebelumnya, disebutkan bahwa tungsten ditemukan di Wolframite dan Scheelita Minerals. Tergantung pada prosesnya, dua senyawa diperoleh dari mereka: tungsten oksida, wo3, atau amonium paratungstate, (NH4)10(H2W12SALAH SATU42) · 4H2O (atau ATP). Salah satu dari mereka berdua dapat direduksi menjadi logam dengan batubara di atas 1050ºC.
Itu dapat melayani Anda: RAULT LAW: Prinsip dan Formula, Contoh, LatihanItu tidak menguntungkan secara ekonomi. Itulah mengapa lebih disukai untuk memproduksinya dalam bentuk debu untuk sekali berurusan dengan logam lain untuk mendapatkan paduan.
Perlu disebutkan bahwa dunia Cina adalah negara dengan produksi tungsten terbesar. Dan di benua Amerika, Kanada, Bolivia dan Brasil, mereka juga menempati daftar produsen terbesar logam ini.
Aplikasi
 Senyawa tungsten karbida: contoh tentang bagaimana kekerasan logam ini dapat digunakan untuk mengabadikan dan mengeras bahan. Sumber: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Senyawa tungsten karbida: contoh tentang bagaimana kekerasan logam ini dapat digunakan untuk mengabadikan dan mengeras bahan. Sumber: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Beberapa kegunaan yang diketahui untuk logam ini disebutkan di bawah ini:
-Garamnya digunakan untuk mewarnai kapas dari pakaian teater tua.
-Dikombinasikan dengan baja semakin mengeras, bahkan mampu menahan potongan mekanis pada kecepatan tinggi.
-Filamen sintering tungsten telah digunakan selama lebih dari seratus tahun di lampu listrik dan lampu terhalogenasi. Juga, karena titik lelehnya yang tinggi telah berfungsi sebagai bahan untuk tabung sinar katoda, dan untuk nozel mesin roket.
-Menggantikan timah dalam pembuatan proyektil dan perisai radioaktif.
-Tungsten nanocables dapat digunakan dalam nanodispositif pH -sensitif.
-Katalis tungsten digunakan untuk menangani produksi belerang di industri minyak.
-Tungsten carbide berasal dari semua senyawa yang mencakup lebih banyak kegunaan. Dari penguatan alat pemotongan dan pengeboran, atau pembuatan potongan persenjataan militer, untuk memekanisasi kayu, plastik dan keramik.
Risiko dan tindakan pencegahan
Biologis
Menjadi logam yang relatif langka di kerak bumi, efek negatifnya langka. Di tanah asam, polytungstate mungkin tidak mempengaruhi enzim yang digunakan oleh molibdat; Tetapi di tanah dasar, wo42- Itu melakukan intervensi (positif atau negatif) dalam proses metabolisme moo42- dan tembaga.
Tumbuhan, misalnya, dapat menyerap senyawa tungsten yang larut, dan dengan memakannya seekor binatang dan kemudian setelah mengonsumsi daging mereka, atom -atomnya memasuki organisme kita. Sebagian besar dikeluarkan dalam urin dan tinja, dan sedikit yang diketahui apa yang terjadi pada mereka yang lain.
Penelitian pada hewan menunjukkan bahwa ketika konsentrasi tinggi bubuk tungsten mengembangkan gejala yang mirip dengan kanker paru -paru.
Dengan konsumsi, manusia dewasa perlu minum ribuan galon air yang diperkaya dengan garam tungsten untuk menunjukkan penghambatan enzim colinesterase dan fosfatase yang cukup.
Fisik
Secara umum, tungsten adalah unsur kecil beracun, dan karena itu ada beberapa risiko inang terhadap kerusakan kesehatan.
Mengenai tungsten logam, Anda harus menghindari menghirup debu; Dan jika sampel padat, harus diperhitungkan bahwa itu sangat padat dan dapat menyebabkan kerusakan fisik jika jatuh atau mengenai permukaan lain.
Referensi
- Bell Terence. (S.F.). Tungsten (Wolfram): Properti, Produksi, Aplikasi & Paduan. Keseimbangan. Pulih dari: keseimbangan.com
- Wikipedia. (2019). Tungsten. Diperoleh dari: di.Wikipedia.org
- Lentech b.V. (2019). Tungsten. Pulih dari: lentech.com
- Jeff Desjardins. (1 Mei 2017). Sejarah Tungsten, logam alami terkuat di bumi. Dipulihkan dari: VisualCapitalis.com
- Doug Stewart. (2019). Fakta Elemen Tungsten. Pulih dari: chemicool.com
- Seni Fisher dan Pam Powell. (S.F.). Tungsten. Universitas Nevada. Pulih dari: unce.a r.Edu
- Helmestine, Anne Marie, PH.D. (2 Maret 2019). Fakta tungsten atau wolfram. Pulih dari: thinkco.com

