Penguapan

- 4919
- 901
- Frederick Pfeffer
 Saat air dipanaskan dalam piring sampai uap terjadi, volatilisasi terjadi. Dengan lisensi
Saat air dipanaskan dalam piring sampai uap terjadi, volatilisasi terjadi. Dengan lisensi Apa itu volatilisasi?
Itu penguapan Ini adalah proses mengubah bahan kimia dari cairan atau keadaan padat menjadi gas atau uap. Istilah lain yang digunakan untuk menggambarkan proses yang sama adalah penguapan, distilasi dan sublimasi.
Suatu zat sering dapat dipisahkan dari yang lain dengan volatilisasi, dan dapat dipulihkan dengan kondensasi uap.
Zat ini dapat diuapkan lebih cepat, baik memanaskannya untuk meningkatkan tekanan uapnya atau dengan mengukus, menggunakan aliran gas inert atau pompa vakum.
Prosedur pemanasan meliputi volatilisasi air, merkuri atau arsenik triklorida untuk memisahkan zat -zat ini dari unsur -unsur interferensial.
Kadang -kadang reaksi kimia digunakan untuk menghasilkan produk yang mudah menguap, seperti dalam pelepasan karbon dioksida dari karbonat, amonia dalam metode kjeldahl untuk penentuan nitrogen dan sulfur dioksida dalam penentuan sulfur baja sulfur.
Metode volatilisasi umumnya ditandai dengan kesederhanaan yang besar dan kemudahan operasi, kecuali jika sangat tahan terhadap korosi tahan atau bahan diperlukan.
Volatilisasi tekanan uap
Mengetahui bahwa suhu air mendidih pada 100 ° C, penting untuk bertanya mengapa air hujan menguap. Jika berada pada 100 ° C, itu harus memberi kita panas.
Perlu juga bertanya apa yang diberikan aroma karakteristik untuk alkohol, cuka, kayu atau plastik.
Orang yang bertanggung jawab untuk semua ini adalah properti yang dikenal sebagai tekanan uap, yang merupakan tekanan yang diberikan oleh uap dalam kesetimbangan dengan fase padat atau cair dari zat yang sama. Juga, tekanan parsial zat di atmosfer pada padatan atau cairan.
Tekanan uap adalah ukuran kecenderungan suatu bahan yang akan diubah ke keadaan gas atau uap, yaitu, ukuran volatilitas zat.
Itu dapat melayani Anda: karbon disulfida (CS2): struktur, sifat, penggunaan, risikoKetika tekanan uap meningkat, semakin besar kapasitas cairan atau padatan untuk menguap, sehingga lebih mudah menguap.
Tekanan uap akan meningkat dengan suhu. Suhu di mana tekanan uap pada permukaan cairan sama dengan tekanan yang diberikan oleh lingkungan disebut titik didih cairan.
Tekanan uap akan tergantung pada zat terlarut yang dilarutkan dalam larutan (itu adalah properti koligatif). Pada permukaan larutan (antarmuka rendah udara), molekul yang paling dangkal cenderung menguap, pertukaran antara fase dan menghasilkan tekanan uap.
Kehadiran zat terlarut mengurangi jumlah molekul pelarut pada antarmuka, mengurangi tekanan uap.
Perubahan tekanan uap dapat dihitung dengan hukum Rault untuk zat terlarut yang tidak volatil, yang diberikan oleh:
(1)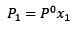 Di mana P1 adalah tekanan uap setelah menambahkan zat terlarut, X1 adalah fraksi molar dari zat terlarut dan p ° adalah tekanan uap dari pelarut murni.
Di mana P1 adalah tekanan uap setelah menambahkan zat terlarut, X1 adalah fraksi molar dari zat terlarut dan p ° adalah tekanan uap dari pelarut murni.
Jika jumlah fraksi molar zat terlarut dan pelarut sama dengan 1 maka kita memiliki:
(2)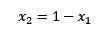
Di mana x2 adalah fraksi molar dari pelarut. Jika kita melipatgandakan kedua sisi persamaan dengan p ° maka tetap:
(3)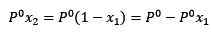
Mengganti (1) dalam (3) tetap:
(4)
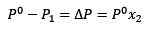
Ini adalah variasi tekanan uap saat zat terlarut larut.
Analisis Gravimetri
Analisis gravimetri adalah kelas teknik laboratorium yang digunakan untuk menentukan massa atau konsentrasi suatu zat dengan mengukur perubahan massa.
Ahli kimia yang kami coba kuantifikasi kadang -kadang disebut analit. Kita bisa menggunakan analisis gravimetri untuk menjawab pertanyaan seperti:
Dapat melayani Anda: mineral logam- Berapa konsentrasi analit dalam suatu larutan?
- Seberapa murni sampel kami? Sampel di sini bisa menjadi solusinya atau dalam solusi.
Ada dua jenis analisis gravimetri yang umum. Keduanya melibatkan perubahan fase analit untuk memisahkannya dari sisa campuran, menimbulkan perubahan adonan.
Salah satu metode ini adalah gravimetri presipitasi, tetapi yang benar -benar menarik minat kita adalah volatilisasi gravimetri.
Gravimetri volatilisasi didasarkan pada termal atau secara kimia sampel dan mengukur perubahan yang dihasilkan dalam massanya.
Atau, kita dapat menangkap dan menimbang produk dekomposisi yang mudah menguap. Karena pelepasan spesies yang mudah menguap adalah bagian penting dari metode ini, kami secara kolektif mengklasifikasikannya sebagai metode analisis volatilisasi gravimetri.
Masalah analisis gravimetri hanyalah masalah stoikiometri dengan beberapa langkah tambahan.
Untuk melakukan perhitungan stoikiometrik apa pun, kami memerlukan koefisien persamaan kimia yang seimbang.
Misalnya, jika sampel mengandung kotoran barium dihidrasi (BACL2● H₂O), Anda bisa mendapatkan jumlah kotoran yang memanaskan sampel untuk menguapkan air.
Perbedaan massa antara sampel asli dan sampel yang dipanaskan akan memberi kita, dalam gram, jumlah air yang terkandung dalam barium klorida.
Dengan perhitungan stoikiometrik sederhana, jumlah kotoran sampel akan diperoleh.
Distilasi fraksional
Distilasi fraksional adalah proses dimana komponen campuran cairan dipisahkan menjadi bagian yang berbeda (disebut fraksi) sesuai dengan titik didih yang berbeda.
Perbedaan volatilitas senyawa campuran memainkan peran mendasar dalam pemisahannya.
Dapat melayani Anda: aturan oktetDistilasi fraksi digunakan untuk memurnikan bahan kimia dan juga untuk memisahkan campuran dan mendapatkan komponennya. Ini digunakan sebagai teknik laboratorium dan dalam industri, di mana prosesnya memiliki kepentingan komersial yang sangat besar.
Uap larutan mendidih dilewatkan di sepanjang kolom tinggi, disebut kolom subdivisi.
Kolom ini dikemas dengan mutiara plastik atau kaca untuk meningkatkan pemisahan, memberikan lebih banyak luas permukaan untuk kondensasi dan penguapan.
Suhu kolom secara bertahap berkurang sepanjang panjangnya. Komponen dengan titik didih yang lebih tinggi terkondensasi di kolom dan kembali ke solusi.
Komponen titik didih yang lebih rendah (lebih mudah menguap) melewati kolom dan dikumpulkan di dekat bagian atas.
Secara teoritis, memiliki lebih banyak mutiara atau pelat meningkatkan pemisahan, tetapi penambahan pelat juga meningkatkan waktu dan energi yang dibutuhkan untuk menyelesaikan distilasi.
Contoh volatilisasi
- Satu blok es kering yang bersentuhan dengan ledakan udara. Udara memulai proses volatilisasi dan es menguap: ia beralih dari keadaan padat ke soda.
- Saat air atau zat lain direbus: panas menghasilkan uap, dan dengan demikian air mengalir dari keadaan cair ke gas.
- Pil naphthalin, yang secara bertahap menurunkan dan melewati dari keadaan padat ke soda.
- Saat sulfur padat mengalami suhu tinggi, itu menjadi gas beracun. Yaitu, ini berubah dari solid ke gas.
- Pil aromasi: mereka memiliki proses yang sama dengan pil naphthalin, secara bertahap terdegradasi dan menjadi gas, berbau dan tidak berbahaya.
Referensi
- Steam Definisi Tekanan. Pulih dari Thoughtco.com.
- Tekanan uap. Pulih dari Britannica.com.

