Oksida non -metalik

- 4030
- 1292
- Irvin Reichel
 Karbon dioksida adalah gas rumah kaca dan juga merupakan oksida non -metalik
Karbon dioksida adalah gas rumah kaca dan juga merupakan oksida non -metalik Apa itu oksida non -metalik?
Itu oksida non -metalik Mereka adalah senyawa biner yang terbentuk antara non -metal dengan keadaan oksidasi positif dan oksigen dengan keadaan oksidasi -2. Juga disebut anhidrida dan asam oksida, senyawa ini cenderung membentuk larutan asam dengan melarutkannya dalam air, dan juga cenderung bereaksi dengan oksida dasar untuk membentuk garam oksisal.
Oksida non logam sangat umum di alam. Faktanya, mereka ada di mana -mana. Air, cairan vital yang mencakup dua pertiga dari permukaan bumi, adalah oksida non -metalik. Begitu juga karbon dioksida yang kita napas selama pernapasan dan sulfur oksida yang mencemari udara dan yang menyebabkan hujan asam.
Dibentuk oleh non -logam dan oksigen (yang juga merupakan non -logam), tautan yang menyatukan atom mereka adalah ikatan kovalen, dalam sebagian besar kasus kutub. Untuk alasan ini, sebagian besar oksida non -metal atau anhidrida memiliki titik didih yang sangat rendah, dan banyak dari mereka adalah gas pada suhu kamar.
Sifat oksida non -metalik
- Mereka tidak memiliki kilau atau kilau logam.
- Mereka dapat memiliki warna yang berbeda.
- Atom -atom mereka disatukan dengan ikatan kovalen alih -alih tautan ionik.
- Mereka dibentuk oleh oksigen dan non -logam.
- Dibandingkan dengan logam oksida, mereka biasanya memiliki titik leleh dan mendidih yang rendah, meskipun sangat beragam.
- Kebanyakan gas, tetapi juga dapat ditemukan di solid state (seperti n2SALAH SATU3) atau cairan pada suhu kamar.
- Oksida non -metalik padat biasanya rapuh dan dapat memiliki kekerasan yang berbeda.
- Mereka adalah konduktor panas dan listrik yang buruk.
- Saat melarutkannya ke dalam air, mereka bereaksi membentuk asam oksasid.
- Beberapa asam oksasisnya adalah asam kuat yang cenderung membentuk anion atau oksiani dalam larutan berair.
- Mereka bereaksi dengan oksida dasar untuk membentuk garam oksisal.
Jenis oksida non -metalik
Tidak ada klasifikasi oksida non -metalik formal atau universal. Namun, ini dapat dikelompokkan sesuai dengan sifat asam-basa mereka.
Meskipun oksida non -metalik juga disebut asam oksida, tidak semuanya selalu bereaksi sebagai asam terhadap senyawa lain. Mengingat hal ini, tiga jenis oksida non -metalik dapat diidentifikasi sesuai dengan sifat asam/basa:
Oksida asam non -metallic
Mereka adalah yang paling umum. Sebagian besar senyawa antara oksigen dan non -logam lainnya, terlepas dari status oksidasi, menghasilkan asam mineral saat melarutkannya dalam air, menimbulkan larutan asam.
- Beberapa contoh oksida asam adalah nitrat anhidrida (n2SALAH SATU5) dan anhidrida sulfat (jadi3).
Oksida non -metalik netral
Beberapa oksida non -metalik tidak bereaksi dengan air sama sekali saat larut di dalamnya. Dalam kasus ini, larutan yang dihasilkan netral (tidak bersifat asam atau basa)).
- Beberapa contoh oksida netral adalah karbon monoksida (CO), nitro oksida (N₂O) dan klorin dioksida (CLO2).
Oksida amfotor non -metalik
Syarat Anfótero Itu mengacu pada kemampuan senyawa kimia untuk berperilaku sebagai asam atau sebagai basa, tergantung pada siapa yang bereaksi terhadap. Yaitu, ini adalah senyawa yang merupakan asam dan basa pada saat bersamaan.
- Di antara oksida non -metalik amphotik, yang paling umum adalah air (h2SALAH SATU). Airnya amfoten, karena mampu memberikan proton ke basa (bertindak sebagai asam), tetapi juga dapat menerima proton asam (bertindak sebagai basa).
Contoh oksida non -metalik
Oksida non -metalik yang paling umum dari masing -masing non -logam disajikan di bawah ini, bersama dengan rumus molekulnya, namanya sesuai dengan nomenklatur sistematis IUPAC, menurut nomenklatur stok dan menurut nomenklatur tradisional:
Karbon oksida
Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
BERSAMA | Karbon monoksida | Karbon oksida (II) | Anhidrida karbon |
CO2 | Karbon dioksida | Karbon oksida (iv) | Karbonik anhidrida |
Nitrogen oksida
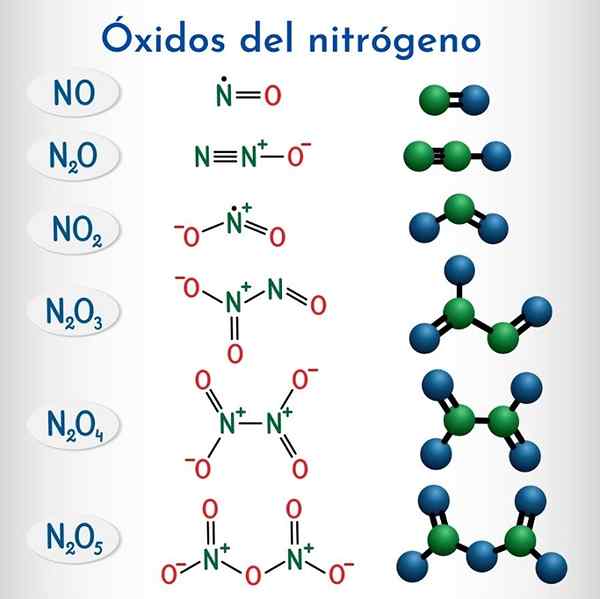 Rumus dan struktur 6 nitrogen oksida non -metalik oksida
Rumus dan struktur 6 nitrogen oksida non -metalik oksida Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
N2o | Dinitrogen monoxide | Nitrogen oksida (I) | Nitro oksida (Hiponitroso anhydride) |
TIDAK | Nitrogen monoksida | Nitrogen oksida (II) | Oksida nitrat |
N2O3 | Dinitrogen trioksida | Nitrogen oksida (III) | Anhidrida nitro |
N2O4 | Dinitrogen tetraxide | Nitrogen oksida (IV) | Nitrogen tetraxide |
No2 | Nitrogen dioksida | Nitrogen oksida (IV) | Nitrogen dioksida |
N2O5 | Dinitrogen pentaoxide | Nitrogen oksida (V) | Anhidrida nitrat |
Fosfor oksida
Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
P2O3 | Trioksida difosfacking | Fosfor oksida (III) | Fosfor anhidrida |
P2O5 | Difosfack pentaoxide | Fosfor oksida (V) | Anhidrida fosfor |
P2O4 | Difosfack tetraxide | Fosfor oksida (III, V) | --- |
Oksida arsenik
Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
AS2O3 | Trioksida Diarsenic | Arsenik oksida (III) | Arsenioso anhydride |
As2o5 | Pentaoksida Diarsenic | Arsenik oksida (v) | Arsenic anhydride |
Antimony oksida
Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
SB2O3 | Trioksida Diantimony | Antimony Oxide (III) | Anhydride antimoni |
SB2O5 | DIANTIMONY PENTAOXIDE | Antimony Oxide (V) | Antimonik anhydride |
Sulfur oksida
Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
Sw | Belerang monoksida | Sulfur oksida (II) | Anhidrida hiposulfur |
SO2 | Sulfur dioksida | Sulfur oksida (iv) | Belerang anhidrida |
SO3 | Sulfur trioksida | Sulfur oksida (VI) | Anhidrida sulfur |
Selenium oksida
Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
Seo | Selenium monoxide | Selenium oksida (II) | Anhidrida hipiplolen |
Seo2 | Selenium dioksida | Selenium oksida (IV) | Selenary Anhydride |
SEO3 | Selenium trioksida | Selenium oksida (VI) | Selénic Anhydride |
Telurio oksida
Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
Teo | Telurio monoxide | Telurio oksida (II) | Anhidrida hypelurous |
Teo2 | Telurio dioksida | Telurio Oxide (IV) | Anhydride telurous |
Teo3 | Telurio Trioxide | Telurio Oxide (VI) | Telluric Anhydride |
Oksida klorin
Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
Cl2o | Klorin monoksida | Klorin oksida (I) | Anhidrida hipoklor |
Cl2o3 | Trioksida klorin | Klorin oksida (III) | Chloro anhydride |
Cl2o5 | Pentaoxide klorin | Klorin oksida (V) | Anhidrida Klorik |
Cl2o7 | Heptoksida klorin | Klorin oksida (VII) | Perchloric anhydride |
Bromine oksida
Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
Br2o | Bromin monoksida | Bromine oksida (I) | Anhidrida hipobrom |
BR2O3 | Trioksida bromin | Bromine oksida (III) | Anhydride brom |
BR2O5 | Bromin pentaoksida | Bromine oksida (V) | Bromik anhidrida |
BR2O7 | Bromin heptaoksida | Bromine oksida (VII) | Anhidrida Perbromik |
Yodium oksida
Rumus | Nama sistematis IUPAC | Nomenklatur stok | Nama tradisional |
I2o | Yodium monoksida | Yodium oksida (i) | Hipoyodoso anhydride |
I2O3 | Trioksida yodium | Yodium oksida (III) | Yodoso anhydride |
I2o5 | Yodium pentaoksida | Yodium oksida (v) | Yodium anhydride |
I2o7 | Yodium heptoksida | Yodium oksida (VII) | Periódicoic anhydride |

