Kalium Yodato (KIO3)
- 4705
- 864
- Mr. Darrell Streich
Apa kalium iodat?
Kalium atau Kalium Yodato Yodato adalah senyawa yodium anorganik, khususnya garam, yang formula kimianya adalah kio3. Yodium atau yodium, elemen dari gugus halogen (f, cl, br, i, as), memiliki garam ini jumlah oksidasi +5; Inilah mengapa ini adalah agen pengoksidasi yang kuat. Kio3 Itu terpisah dalam media berair untuk membuat ion k+ dan io3-.
Ini disintesis dengan bereaksi kalium hidroksida dengan asam yodium: HIO3(aq) + koh (s) => kio3(aq) + h2Atau (l). Juga, dapat disintesis dengan bereaksi yodium molekul dengan kalium hidroksida: 3i2(s)+6koh (s) => kio3(aq) + 5ki (aq) + 3h2Atau (l).
Sifat Kalium Yodato
 Penampilan Kalium Yodato
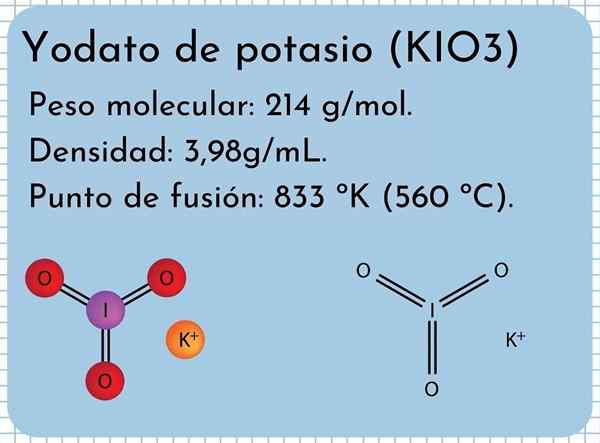
Penampilan Kalium Yodato Ini adalah kristal padatan putih yang tidak berbau dan dengan struktur kristal monoklinik. Ini memiliki kepadatan 3,98g/mL, berat molekul 214 g/mol dan menyajikan pita penyerapan dalam spektrum inframerah (IR).
Ini memiliki titik leleh: 833 ºK (560 ºC), terdiri dari interaksi ionik yang kuat antara ion k+ dan io3-. Pada suhu yang lebih tinggi, reaksi dekomposisi termal, melepaskan oksigen molekuler dan kalium iodida:
2Kio3(S) => 2KI + 3O2(G)
Dalam air ia memiliki kelarutan yang bervariasi dari 4,74g/100ml hingga 0 ºC, hingga 32,3 g/100ml pada 100 ºC, menghasilkan solusi berair yang tidak berwarna. Selain itu, tidak larut dalam alkohol dan asam nitrat, tetapi larut dalam asam sulfat encer.
Afinitasnya terhadap air tidak berarti, yang menjelaskan mengapa itu tidak higroskopis dan tidak ada dalam bentuk garam terhidrasi (kio3· H2SALAH SATU).
Agen pengoksidasi
Kalium yodato, seperti yang ditunjukkan oleh formula kimianya, memiliki tiga atom oksigen. Ini adalah elemen yang sangat elektronegatif dan, karena sifat ini, ia meninggalkan "ditemukan" defisiensi awan elektronik yang mengelilingi yodium.
Dapat melayani Anda: gas inertKekurangan ini - atau kontribusi, sebagaimana kasusnya - dapat dihitung sebagai nomor oksidasi yodium (± 1, +2, +3, +5, +7), menjadi +5 dalam hal garam ini.
Apa artinya ini? Bahwa sebelum spesies yang mampu memberikan elektron, yodium akan menerimanya dalam bentuk ionik mereka (IO3-) menjadi yodium molekuler dan memiliki bilangan oksidasi yang sama dengan 0.
Mengikuti penjelasan ini, dapat ditentukan bahwa kalium iodat adalah senyawa pengoksidasi yang bereaksi secara intens dengan agen pereduksi dalam banyak reaksi redoks; Dari semua ini, seseorang dikenal sebagai jam yodium.
Jam yodium terdiri dari proses redoks langkah -langkah lambat dan cepat, di mana langkah cepat ditandai dengan solusi KIO3 Dalam asam sulfat yang ditambahkan pati. Kemudian, pati -ompo diproduksi dan berlabuh di antara strukturnya spesies i3-- Ini akan membuat solusi biru berwarna -warni menjadi biru tua.
Io3- + 3 HSO3- → i- + 3 HSO4-
Io3- + 5 i- + 6 h+ → 3 i2 + 3 h2SALAH SATU
yo2 + Hso3- + H2O → 2 i- + Hso4- + 2 h+ (biru tua karena pati)
Struktur kimia
 Struktur Kalium Yodato
Struktur Kalium Yodato Dalam gambar superior struktur kimia kalium iodat diilustrasikan. IO anion3- Itu diwakili oleh "tripod" dari bola merah dan ungu, sedangkan ion k+ Mereka diwakili oleh bola ungu.
Tapi apa arti tripod ini? Bentuk geometris yang benar dari anion ini sebenarnya adalah piramida trigonal, di mana oksigen membentuk basis segitiga, dan torsi yodium yang tidak dibesarkan di lantai atas, menempati ruang dan memaksa untuk melipat tautan I-O dan kedua tautan I = O = O.
Dapat melayani Anda: asam tartaratGeometri molekuler ini sesuai dengan hibridisasi SP3 atom sentral yodium; Namun, perspektif lain menunjukkan bahwa salah satu atom oksigen membentuk tautan ke orbital "d" yodium, sebenarnya menjadi hibridisasi tipe SP3D2 (Yodium dapat memiliki orbital "D" yang memperluas lapisan Valencia -nya).
Kristal garam ini dapat mengalami transisi fase struktural (pengaturan lain selain monoklinik) sebagai konsekuensi dari kondisi fisik yang berbeda yang membuat mereka menundukkan mereka.
Penggunaan dan aplikasi kalium iodat
Penggunaan terapi
Kalium yodato biasanya digunakan untuk menghindari akumulasi radioaktivitas dalam tiroid dalam bentuk 131Saya, ketika isotop ini digunakan dalam menentukan yodium dengan tiroid sebagai komponen pengoperasian kelenjar tiroid.
Demikian juga, kalium yodato digunakan sebagai antiseptik topikal (0,5 %) pada selaput lendir.
Gunakan dalam industri
Itu ditambahkan ke makanan hewan pengembangbiakan sebagai suplemen yodium. Oleh karena itu, kalium yodato digunakan dalam industri untuk meningkatkan kualitas tepung.
Penggunaan analitik
Dalam kimia analitik, berkat stabilitasnya, ini digunakan sebagai pola utama dalam standardisasi pola natrium tiosulfat (NA2S2SALAH SATU3), dengan tujuan menentukan konsentrasi yodium dalam masalah masalah.
Ini berarti bahwa jumlah yodium dapat diketahui dengan teknik volumetrik (derajat). Dalam reaksi ini kalium iodat teroksidasi dengan cepat menjadi ion iodida i-, Melalui persamaan kimia berikut:
Dapat melayani Anda: Timbal Asetat: Struktur, Properti, Memperoleh, PenggunaanIo3- + 5i- + 6h+ => 3i2 + 3H2SALAH SATU
Yodium, saya2, berjudul dengan Solusi NA2S2SALAH SATU3 untuk standardisasi.
Gunakan dalam teknologi laser
Studi telah menunjukkan dan menguatkan piezoelektrik yang menarik, piroelektrik, elektrooptic, ferroelektrik dan sifat optik non -linear dari kristal KIO3. Ini menghasilkan potensi besar di bidang elektronik dan teknologi laser untuk bahan yang dibuat dengan senyawa ini.
Risiko Kesehatan Kalium Yodate
Dalam dosis tinggi dapat menyebabkan iritasi pada mukosa oral, kulit, mata dan saluran udara.
Eksperimen toksisitas kalium iodat pada hewan telah memungkinkan kami untuk mengamati bahwa pada anjing dengan cepat, pada dosis 0,2-0,25 g/kg berat badan, disediakan secara oral, senyawa tersebut menyebabkan muntah.
Jika muntah ini dihindari, ia menghasilkan pada hewan yang memburuknya situasi mereka, karena anoreksia dan sebelum kematian diinduksi. Otopsinya diizinkan untuk mengamati lesi hati nekrotik, ginjal dan mukosa usus.
Karena kekuatan pengoksidasi, itu mewakili risiko kebakaran ketika bersentuhan dengan bahan yang mudah terbakar.
Referensi
- Hari, r., & Underwood, a. Kimia analitik kuantitatif (Edisi kelima.). Pearson Prentice Hall, P-364.
- Buku Kimia. (2017). Kalium iodat. Diperoleh pada 25 Maret 2018, dari Chemicalbook: Chemicalbook.com
- Pubchem. (2018). Kalium iodat. Diperoleh pada 25 Maret 2018, dari Pubchem: Pubchem.NCBI.Nlm.Nih.Pemerintah
- Merck. (2018). Kalium Yodato. Diperoleh pada 25 Maret 2018, dari Merck:
- Merckmillipore.com
- M M Abdel Kader et al. (2013). Mekanisme transportasi muatan dan transisi fase suhu rendah di KIO3. J. Phys.: Conf. Menjadi. 423 012036

