Afinitas elektronik

- 882
- 28
- Frederick Pfeffer
Apa itu afinitas elektronik?
Itu Afinitas elektronik Ini didefinisikan sebagai jumlah energi yang dilepaskan ketika mol atom dalam keadaan gas dikombinasikan dengan mol elektron untuk membentuk mol anion, juga dalam keadaan gas gas. Dengan kata lain, ini mengacu pada negatif dari variasi entalpi dari proses berikut:
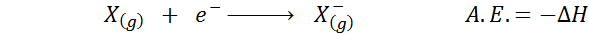
Sesuai namanya, afinitas elektronik (a.DAN.) Ini adalah ukuran tren yang memiliki atom untuk bergabung dengan elektron. Yaitu, mengukur afinitas atom untuk elektron.
Interpretasi afinitas elektronik
Karena cara didefinisikan, afinitas elektronik yang tinggi menyiratkan bahwa variasi entalpi sangat negatif. Ini, pada gilirannya, menunjukkan bahwa prosesnya sangat menguntungkan dan bahwa produk lebih stabil daripada reagen. Untuk alasan ini, kita juga bisa mengatakan bahwa afinitas elektronik adalah ukuran tidak langsung dari stabilitas anion.
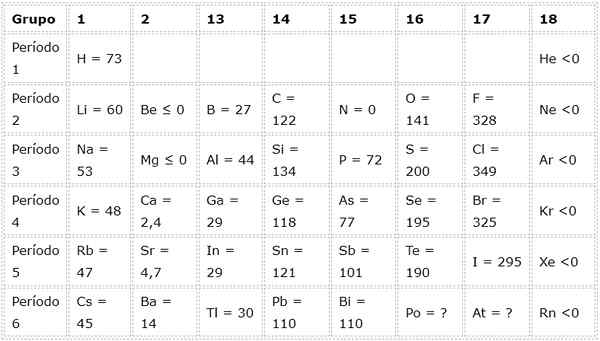
Semakin besar afinitas elektronik atom, semakin besar tren untuk membentuk anion. Inilah sebabnya mengapa atom seperti klorin, yang afinitas elektroniknya adalah 349 kJ/mol, cenderung membentuk anion dengan mudah (dalam hal ini anion klorida), sedangkan atom lain seperti magnesium, yang afinitas elektroniknya negatif, tidak membentuk anion.
Klarifikasi tentang afinitas elektronik dan energi ionisasi
Sering kali Anda berpikir tentang afinitas elektronik sebagai kebalikan dari energi ionisasi (kecenderungan atom gas untuk kehilangan elektron), tetapi tidak demikian halnya. Pertimbangkan, misalnya, atom x.
Itu dapat melayani Anda: tusfrano: struktur kimia, sifat dan penggunaanAfinitas elektroniknya mengacu pada perubahan energi dari proses yang ditunjukkan di atas dalam persamaan pertama. Namun, energi ionisasi mengacu pada perubahan energi ketika atom kehilangan elektron:
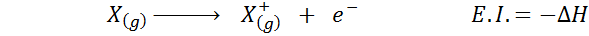
Meskipun reaksi ini tampaknya menjadi reaksi yang berlawanan dengan yang sebelumnya.
Apa yang menentukan afinitas elektronik?
Untuk mengetahui karakteristik atom apa yang mempengaruhi nilai afinitas elektroniknya, stabilitas atom asli harus dipertimbangkan, serta anion yang terbentuk. Jika anion lebih stabil daripada atom, maka afinitas elektronik akan tinggi, jika tidak maka akan rendah atau bahkan negatif.
Tapi bagaimana mengetahui mana dari dua spesies yang lebih stabil? Untuk itu, kami mengandalkan dua faktor:
- Konfigurasi elektronik. Ada pengaturan elektronik yang lebih stabil daripada yang lain. Secara umum, konfigurasi lapisan penuh (seperti gas mulia) adalah yang paling stabil dari semuanya. Kemudian diikuti oleh konfigurasi lapisan semi-llena, di mana semua orbital dari lapisan Valencia memiliki setengah dari elektron yang bisa mereka miliki (misalnya, 4s14p3).
- Repulsi elektronik. Jika anion beban -1 dibandingkan, dengan anion beban -2, dalam kasus kedua akan ada jauh lebih banyak tolakan antar elektron, yang mengacaukan anion.
Kecenderungan afinitas elektronik berkala
 Grafik yang menunjukkan afinitas elektronik dari 9 elemen pertama dari tabel periodik
Grafik yang menunjukkan afinitas elektronik dari 9 elemen pertama dari tabel periodik Afinitas elektronik adalah salah satu sifat periodik dari elemen. Artinya, itu adalah properti yang bervariasi dari satu elemen ke elemen lain tergantung pada posisinya di tabel periodik. Secara umum, afinitas elektronik meningkat ketika ukuran atom berkurang.
Itu dapat melayani Anda: Formula semi -berkembang: apa dan contoh (metana, propana, butana ...)Dalam pengertian ini, ukuran atom bervariasi tergantung pada periode dan kelompok di mana ia berada, sehingga afinitas elektroniknya juga bervariasi seperti yang dijelaskan di bawah ini:
Variasi afinitas elektronik selama suatu periode
Setidaknya untuk elemen yang representatif (yang termasuk dalam blok S dan P dari tabel periodik), dapat diamati bahwa afinitas elektronik memiliki kecenderungan umum untuk meningkat dari kiri ke kanan, karena peningkatan beban nuklir yang efektif itu mampu menarik elektron dengan kekuatan yang lebih besar.
Misalnya, jika kita mengambil periode ke -3 dari tabel periodik, kita dapat melihat bahwa afinitas elektronik Li (60 kJ/mol) kurang dari oksigen (141 kJ/mol) dan ini kurang dari fluoride (328 kJ /mol).
Pengecualian
Aturan sebelumnya tidak selalu terpenuhi.
Pertama, saat bergerak dari logam basa ke alkalin, afinitas elektronik berkurang. Ini karena untuk logam alkali (konfigurasi elektronik NS1) Sungguh menguntungkan untuk menangkap elektron, karena mereka akan selesai mengisi orbital mereka.
Dalam kasus Alkalineros (Konfigurasi Elektronik NS2) Menangkap elektron tidak menguntungkan karena mereka sudah memiliki orbital penuh. Hal yang sama terjadi saat bergerak dari halogen (yang memiliki afinitas elektronik dari semua elemen) ke gas mulia.
Variasi afinitas elektronik di seluruh kelompok
Dalam kasus kelompok, perilaku bahkan kurang dapat diprediksi. Aturan umum adalah bahwa a.DAN. meningkat dari bawah ke atas, dalam arah yang sama yang mengurangi jari -jari atom. Untuk logam alkali dan halogen, aturan ini dipenuhi dengan cukup baik. Namun, ini tidak terjadi dengan kebanyakan kelompok lain.
Dapat melayani Anda: kobalt hidroksidaContoh afinitas elektronik dari beberapa elemen representatif
Tabel berikut menunjukkan nilai afinitas elektronik dalam (kJ/mol) dari Elemen perwakilan Diurutkan berdasarkan grup:
Di bawah ini adalah beberapa contoh afinitas elektronik bersama dengan reaksi yang mereka rujuk:
1. Afinitas elektronik hidrogen
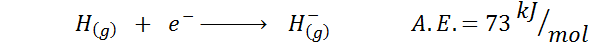
2. Afinitas oksigen elektronik
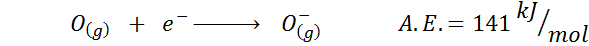
3. Afinitas elektronik anion
Contoh umum lainnya adalah kasus afinitas elektronik dari anion seperti atau-. Sebuah.DAN. Dalam hal ini diberikan oleh energi yang terkait dengan proses berikut:
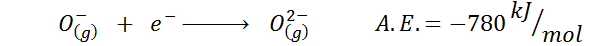
Seperti yang dapat dilihat, afinitas elektronik ini sangat negatif, meskipun ion atau2- Ini memiliki konfigurasi neon elektronik (gas mulia) dan menjadi ion yang sangat umum di banyak padatan ionik.
Alasannya adalah penolakan biaya negatif di OR2- Mengacaukan ion gas ini, tetapi dalam keadaan padat beban stabil oleh kation yang mengelilinginya.

