Agen reduksi konsep, contoh terkuat

- 3919
- 503
- Ray Thiel
A agen pereduksi Itu adalah zat yang memenuhi fungsi mengurangi zat pengoksidasi dalam reaksi reduksi oksida. Agen pereduksi pada dasarnya adalah donor elektron, biasanya zat yang berada pada tingkat oksidasi terendah dan dengan jumlah elektron yang tinggi.
Ada reaksi kimia di mana keadaan oksidasi atom bervariasi. Reaksi ini melibatkan proses reduksi dan oksidasi komplementer. Dalam reaksi ini, satu atau lebih elektron dari satu molekul, atom atau ion dipindahkan ke molekul, atom atau ion lain. Ini menyiratkan produksi reaksi reduksi oksida.

Selama proses pengurangan oksida, elemen atau senyawa yang kehilangan (atau DONA) elektron (atau elektron) disebut zat pereduksi, kontras dengan zat pengoksidasi yang merupakan reseptor elektron. Kemudian dikatakan bahwa agen pereduksi mengurangi zat pengoksidasi, dan bahwa agen pengoksidasi mengoksidasi agen pereduksi.
Agen pereduksi terbaik atau terkuat adalah yang memiliki radio atom terbesar; yaitu, mereka memiliki jarak yang lebih besar dari nukleus mereka ke elektron yang mengelilingi hal yang sama.
Agen pereduksi biasanya ion logam atau negatif. Di antara agen pereduksi yang umum adalah asam askorbat, sulfur, hidrogen, zat besi, lithium, magnesium, mangan, kalium, natrium, vitamin C, seng dan bahkan ekstrak wortel.
[TOC]
Apa agen pereduksi?
Seperti yang telah dikatakan, agen pereduksi bertanggung jawab untuk mengurangi agen pengoksidasi ketika terjadi reaksi reduksi oksida.
Reaksi sederhana dan tipikal dari reaksi reduksi oksida adalah respirasi seluler aerob:
Dapat melayani Anda: aluminium hydride (ALH3): Struktur, sifat, penggunaanC6H12SALAH SATU6(s) + 6o2(g) → 6co2(g) + 6h2Atau (l)
Dalam hal ini, di mana glukosa (c6H12SALAH SATU6) bereaksi dengan oksigen (atau2), glukosa berperilaku sebagai agen pereduksi untuk memberikan elektron pada oksigen - yaitu, ia dioksidasi - dan oksigen menjadi agen pengoksidasi.
Dalam kimia organik, agen pereduksi terbaik dianggap reagen yang menyediakan hidrogen (h2) untuk reaksi. Dalam bidang kimia ini, reaksi reduksi mengacu pada penambahan hidrogen ke molekul, meskipun definisi sebelumnya (reaksi reduksi oksida juga berlaku.
Faktor -faktor yang menentukan kekuatan agen pereduksi
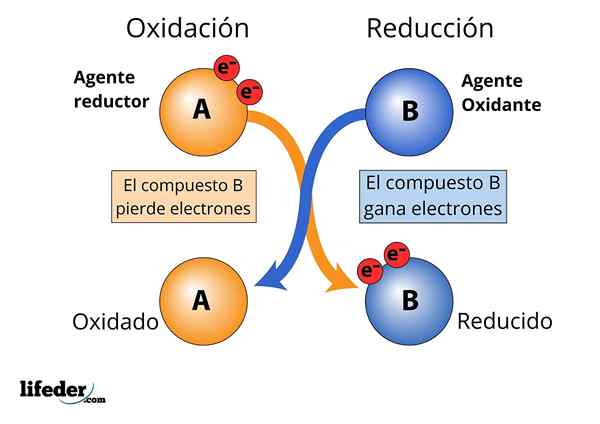 Mengoksidasi dan mengurangi agen, kehilangan elektron dan gain diamati
Mengoksidasi dan mengurangi agen, kehilangan elektron dan gain diamati Agar suatu zat dianggap "kuat".
Untuk ini, ada sejumlah faktor yang harus diperhitungkan untuk mengenali kekuatan yang mungkin dimiliki agen pereduksi: elektronegativitas, jari -jari atom, energi ionisasi dan potensi pengurangan.
Elektronegativitas
Electronegativity adalah properti yang menggambarkan kecenderungan atom menarik beberapa elektron yang disatukan pada dirinya sendiri. Semakin tinggi elektronegativitas, semakin besar gaya tarik yang diberikan oleh atom tentang elektron di sekitarnya.
Dalam tabel periodik, elektronegativitas meningkat dari kiri ke kanan, jadi logam alkali adalah elemen elektronegatif terkecil.
Radio atom
Itu adalah properti yang mengukur jumlah atom. Ini mengacu pada jarak khas atau rata -rata dari pusat inti atom ke perbatasan awan elektronik yang mengelilinginya.
Dapat melayani Anda: nitrit: properti, struktur, nomenklatur, formasiProperti ini tidak tepat - dan di samping itu, beberapa gaya elektromagnetik terlibat dalam definisinya - tetapi diketahui bahwa nilai ini menurun dari kiri ke kanan dalam tabel periodik, dan meningkat dari atas ke bawah. Inilah sebabnya mengapa logam alkali, terutama cesium, dianggap sebagai radio atom yang lebih besar.
Energi ionisasi
Properti ini didefinisikan sebagai energi yang diperlukan untuk menghilangkan elektron yang kurang bersatu dari atom (elektron valencia) untuk membentuk kation.
Dikatakan bahwa semakin dekat elektron dengan inti atom di sekitarnya, semakin besar energi ionisasi atom.
Energi ionisasi meningkat dari kiri kanan dan dari bawah ke atas dalam tabel periodik. Sekali lagi, logam (terutama basa) memiliki lebih sedikit energi ionisasi.
Potensi pengurangan
Ini adalah ukuran kecenderungan spesies kimia untuk mendapatkan elektron dan, oleh karena itu, dikurangi. Setiap spesies memiliki potensi reduksi intrinsik: semakin besar potensi, semakin besar afinitasnya dengan elektron dan juga kemampuannya untuk dikurangi.
Agen pereduksi adalah zat -zat tersebut dengan potensi pengurangan yang lebih sedikit, karena afinitas kecilnya dengan elektron.
Agen pereduksi yang lebih kuat
Dengan faktor -faktor yang dijelaskan di atas, dapat disimpulkan bahwa untuk menemukan agen pereduksi "kuat", atom atau molekul dengan elektronegativitas rendah, jari -jari atom tinggi dan energi ionisasi rendah diinginkan.
Seperti yang telah disebutkan, logam alkali menyajikan karakteristik ini dan dianggap sebagai agen pereduksi terkuat.
Dapat melayani Anda: hidrokarbon alifatik: sifat, nomenklatur, reaksi, jenisDi sisi lain, lithium (LI) dianggap sebagai agen pereduksi terkuat untuk memiliki potensi reduksi terendah, sedangkan molekul Lialh4 Ini dianggap sebagai agen pereduksi terkuat dari semuanya, untuk mengandung ini dan karakteristik yang diinginkan lainnya.
Contoh reaksi dengan agen pereduksi
Ada banyak kasus pengurangan oksida dalam kehidupan sehari-hari. Di bawah ini adalah beberapa yang paling representatif:
Contoh 1
Reaksi pembakaran oktan (komponen utama bensin):
2 c8H18(l) + 25o2 → 16co2(g) + 18h2O (g)
Anda dapat melihat bagaimana oktan (agen pereduksi) elektron oksigen dona (agen pengoksidasi), membentuk karbon dioksida dan air dalam jumlah besar.
Contoh 2
Hidrolisis glukosa adalah contoh lain yang berguna dari reduksi umum:
C6H12SALAH SATU6 + 2ADP + 2P + 2NAD+ → 2ch3KELAPA2H + 2atp + 2nadh
Dalam reaksi ini molekul NAD (reseptor elektron dan zat pengoksidasi dalam reaksi ini) ambil elektron glukosa (agen pereduksi).
Contoh 3
Akhirnya, dalam reaksi oksida besi
Keyakinan2SALAH SATU3(s) + 2al (s) → ke2SALAH SATU3(s) + 2fe (l)
Zat pereduksi adalah aluminium, sedangkan zat pengoksidasi adalah zat besi.
Referensi
- Wikipedia. (S.F.). Wikipedia. Diperoleh dari dalam.Wikipedia.org
- BBC. (S.F.). BBC.bersama.Inggris. Diperoleh dari BBC.bersama.Inggris
- Pearson, d. (S.F.). Libretteks Kimia. Diperoleh dari kimia.Librettexts.org
- Penelitian, b. (S.F.). Web Penelitian Bodner. Diperoleh dari Murmed.Chem.Purdue.Edu
- Peter Atkins, L. J. (2012). Prinsip Kimia: Pencarian Wawasan.
- « Sifat cassia angustifolia, persiapan, kontraindikasi
- Karakteristik Proyeksi Azimutal, Jenis, Keuntungan, Kerugian »

