Struktur alkohol primer, sifat, nomenklatur, contoh

- 1782
- 471
- Ray Thiel
A alkohol primer Ini adalah salah satu di mana gugus hidroksil terkait dengan karbon primer; Ini adalah, karbon yang terpasang secara kovalen ke karbon dan hidrogen lain. Formula umumnya adalah ROH, khususnya RCH2Oh, karena hanya ada satu grup rental r.
RCH Formula R Group R2Oh itu bisa siapa saja: rantai, cincin, atau heteroatom. Ketika datang ke rantai, pendek atau panjang, itu sebelum alkohol primer yang paling representatif; Di antara mereka adalah metanol dan etanol, dua dari yang paling disintesis di tingkat industri.
 Toples bir: Contoh larutan berair etil alkohol, alkohol primer, dalam matriks organik. Sumber: Engin Akyurt via Pexels.
Toples bir: Contoh larutan berair etil alkohol, alkohol primer, dalam matriks organik. Sumber: Engin Akyurt via Pexels. Secara fisik mereka seperti alkohol lain, dan titik -titik mendidih atau fusi mereka tergantung pada tingkat konsekuensi mereka; Tapi secara kimia, mereka adalah yang paling reaktif. Selain itu, keasamannya lebih unggul daripada alkohol sekunder dan tersier.
Alkohol primer mengalami reaksi oksidasi, menjadi sejumlah besar senyawa organik: ester dan eter, aldehida dan asam karboksilat. Mereka juga dapat menderita reaksi dehidrasi, menjadi alkena atau olefin.
[TOC]
Struktur alkohol primer
Alkohol primer yang berasal dari alkana linier adalah yang paling representatif. Namun, pada kenyataannya struktur apa pun, apakah linier atau bercabang, dapat diklasifikasikan dalam jenis alkohol ini selama kelompok OH terkait dengan CH2.
Jadi, secara struktural setiap orang memiliki kesamaan dengan kehadiran kelompok -ch2Oh, disebut methylol. Karakteristik dan konsekuensi dari fakta ini adalah bahwa kelompok OH kurang dicegah; yaitu, dapat berinteraksi dengan lingkungan tanpa atom lain yang menghambat secara spasial.
Juga, OH yang kurang dicegah berarti bahwa atom karbon yang membawanya, memilih2, mungkin menderita reaksi penggantian melalui mekanisme SN2 (bimolekul, tanpa pembentukan karbokasi).
Di sisi lain, OH dengan kebebasan yang lebih besar untuk berinteraksi dengan lingkungan, diterjemahkan sebagai interaksi antarmolekul yang lebih kuat (oleh jembatan hidrogen), yang pada gilirannya meningkatkan fusi atau titik didih titik.
Itu dapat melayani Anda: nikel hidroksida (III): struktur, sifat, penggunaan, risikoIni juga terjadi dengan kelarutannya dalam pelarut kutub, selama kelompok R tidak terlalu hidrofobik.
Properti
Keasaman
Alkohol primer berasal dari semua yang paling asam. Agar alkohol berperilaku seperti asam brnsted, ion h harus menyumbang+ Di tengah, untuk mengatakan air, untuk menjadi anion alkitab:
ROH + H2EMAS- + H3SALAH SATU+
Beban negatif merah-, khusus dari RCH2SALAH SATU-, Merasa kurang tolakan pada bagian elektron dari dua ikatan C-H, dibandingkan dengan elektron dari ikatan C-R.
Kelompok sewaan kemudian melaksanakan tolakan terbesar, destabilisasi RCH2SALAH SATU-; tetapi tidak begitu banyak dibandingkan dengan fakta bahwa jika ada dua atau tiga kelompok R, seperti halnya dengan alkohol sekunder dan tersier, masing -masing.
Cara lain untuk menjelaskan keasaman terbesar dari alkohol primer adalah melalui perbedaan dalam elektronegativitas, menciptakan momen dipol: h2Cδ+-SALAH SATUδ-H. Oksigen menarik kepadatan elektronik keduanya dari CH2 pada H; Beban parsial positif dari karbon mengusir sedikit hidrogen.
Grup R mentransfer sedikit kepadatan elektroniknya ke Cho2, yang membantu mengurangi beban parsial positif dan dengan itu tolakannya untuk beban hidrogen. Semakin banyak kelompok Ra, semakin rendah tolakan, dan oleh karena itu, tren H untuk dilepaskan sebagai h+.
PKA
Alkohol primer dianggap asam terlemah daripada air, dengan pengecualian metil alkohol, yang sedikit lebih kuat. PKA dari metil alkohol adalah 15.2; Dan PKA etil alkohol adalah 16.0. Sementara itu, PKA air adalah 15.7.
Namun, air yang dianggap asam lemah, seperti alkohol, dapat bergabung dengan h+ Untuk berubah menjadi ion hidrium, h3SALAH SATU+; Artinya, itu berperilaku seperti basis.
Dengan cara yang sama, alkohol primer dapat menangkap hidrogen; Terutama dalam beberapa reaksi yang sendiri, misalnya, dalam transformasi mereka menjadi alkena atau olefin.
Reaksi kimia
Sewa Formasi Halogenuros
Alkohol bereaksi dengan hidrogen halogenida untuk menghasilkan alkil halogenida. Reaktivitas alkohol di depan hidrogen halogenida, turun dalam urutan berikut:
Dapat melayani Anda: karbonAlkohol tersier> alkohol sekunder> alkohol primer
RoH +hx => rx +h2SALAH SATU
RX adalah alkil halogenida primer (pilih3Cl, ch3Ch2BR, dll.).
Cara lain untuk menyiapkan alkil halogenuros adalah melalui reaksi tionilo chloride, reagen sintetis, dengan alkohol primer yang menjadi alkil klorida. Tionilo chloride (socl2) perlu bereaksi keberadaan piridin.
Ch3(Ch2)3Ch2Oh +Socl2 => Ch3(Ch2)3Ch2Cl +Jadi2 + Hcl
Reaksi ini sesuai dengan halogenasi 1-penol untuk menjadi 1-clloropentano di hadapan piridin.
Oksidasi alkohol primer
Alkohol dapat dioksidasi menjadi aldehida dan asam karboksilat, tergantung pada reagen. Pyridinium chlorochromate (PCC) mengoksidasi alkohol primer menjadi aldehida, menggunakan diklorometana sebagai pelarut (CH2Cl2):
Ch3(Ch2)5Ch2Oh => cho3(Ch2)5COH
Ini adalah oksidasi 1-heptanol dalam 1-heptanal.
Sementara itu, kalium permanganat (kmno4) alkohol alkohol terlebih dahulu, dan kemudian dioksidasi menjadi aldehida menjadi asam karboksilat. Ketika kalium permanganat digunakan untuk mengoksidasi alkohol, pemecahan hubungan antara karbon 3 dan 4 harus dihindari.
Ch3(Ch2)4Ch2Oh => cho3(Ch2)4Cooh
Ini adalah oksidasi asam heksanol 1 menjadi asam heksanoat.
Dengan metode ini sulit untuk mendapatkan aldehida, karena mudah mengoksidasi asam karboksilat. Situasi serupa diamati ketika asam kromik digunakan untuk mengoksidasi alkohol.
Formasi E éteres
Alkohol primer dapat menjadi eter ketika dipanaskan di hadapan katalis, biasanya asam sulfat:
2 rch2Oh => rch2Och2R +h2SALAH SATU
Formasi Esares Organik
Kondensasi alkohol dan asam karboksilat, esterifikasi fisher, dikatalisis oleh asam, menghasilkan ester dan air:
Dapat melayani Anda: karbokation: pembentukan, karakteristik, jenis, stabilitasR'oh +rcooh rcoor ' +h2SALAH SATU
Reaksi yang diketahui adalah etanol dengan asam asetat, untuk memberikan etil asetat:
Ch3Ch2Oh +ch3COOH CH3Coohch2Ch3 + H2SALAH SATU
Alkohol primer adalah yang paling rentan terhadap reaksi sterifikasi Fischer.
Dehidrasi
Pada suhu tinggi dan dalam medium asam, biasanya asam sulfat, alkohol dehidrasi menyebabkan alkena dengan kehilangan molekul air.
Ch3Ch2Oh => h2C = ch2 + H2SALAH SATU
Ini adalah reaksi dehidrasi etanol terhadap etilen. Formula umum yang lebih tepat untuk jenis reaksi ini, khususnya untuk alkohol primer, adalah: adalah:
Rch2Oh => r = cho2 (Apa yang juga sama dengan rc = ch2)
Tata nama
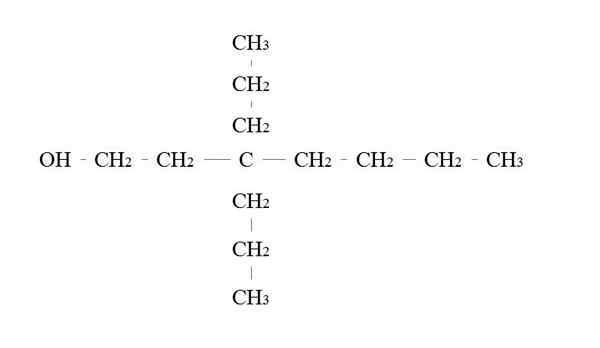 Contoh alkohol primer. Sumber: Gabriel Bolívar.
Contoh alkohol primer. Sumber: Gabriel Bolívar. Aturan untuk menyebutkan alkohol primer sama dengan alkohol lainnya; Dengan pengecualian, bahwa kadang -kadang tidak perlu untuk menyebutkan pembawa OH.
Di gambar atas ada rantai tujuh -karbon utama. Karbon yang terkait dengan OH diberi jumlah 1, dan kemudian mulai menghitung dari kiri ke kanan. Oleh karena itu, nama IUPAC-nya: 3,3-dietilheptanol.
Perhatikan bahwa ini adalah contoh alkohol primer yang sangat bercabang.
Contoh
Akhirnya, beberapa alkohol utama disebutkan sesuai dengan nomenklatur tradisional dan sistematis mereka:
-Methyl, ch3Oh
-Ethyl, ch3Ch2Oh
-N-propyl, ch3Ch2Ch2Oh
-N-hexyl, ch3Ch2Ch2Ch2Ch2Ch2Oh
Ini berasal dari alkana linier. Contoh lainnya adalah:
-2-Fenyletanol, c6H5Ch2Ch2Oh (c6H5 = cincin benzena)
-2-propen-1-OC (alkohol allilic), CHO2= Chch2Oh
-1,2-taodiol, ch2Ohch2Oh
-2-chloroetanol (ethyleclorhydrin), clch2Ch2Oh
-2-buten-1-ol (alkohol crotilic), ch3Ch = chch2Oh
Referensi
- Morrison, r.T. Dan Boyd, R. N. (1987). Kimia organik. (5ta Edisi). Addison-Wesley Iberoamericana
- Carey, f. KE. (2008). Kimia organik. (6ta Edisi). McGraw-Hill, Intermerica, Editor S.KE.
- Mel Science. (2019). Bagaimana oksidasi alkohol primer terjadi. Pulih dari: Melscience.com
- Royal Society of Chemistry. (2019). Definisi: alkohol primer. Pulih dari: rsc.org
- Chriss E. McDonald. (2000). Oksidasi alkohol primer menjadi ester: tiga percobaan investigasi terkait. J. Chem. Educ., 2000, 77 (6), p 750. Doi: 10.1021/ed077p750

